题目内容
6.H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.(1)某化学活动小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.所用试剂:30%H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水.
①写出实验中H2O2分解反应方程式:2H2O2$\frac{\underline{\;Fe_{2}(SO_{4})_{3}\;}}{\;}$2H2O+O2↑.
②设计实验方案:在不同H2O2浓度下,测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少(要求所测得的数据能直接体现反应速率大小).
③根据上述实验要求,请将表格补充完整.
物理量 实验序号 | 0.1mol?L-1Fe2(SO4)3 的体积/mL | 30% H2O2 的体积/mL | H2O 的体积/mL |
| 1 | 0.5 | 15 | 24.5mL |
| 2 | 0.5 | 30 | 9.5 |
(2)利用图2-(a)和(b)中的信息,按图(c)装置(连接的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是由图(a)可知H2O2分解为放热反应,H2O2分解使B瓶中温度升高,再由图(b)可知反应2NO2(g)
 N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.
N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.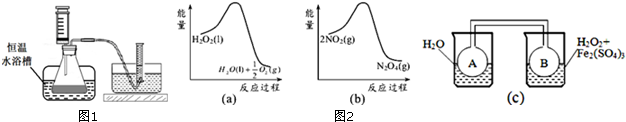
分析 (1)①过氧化氢在硫酸铁作催化剂条件下分解生成水与氧气;
②反应速率表示单位时间内物质的量浓度变化量,测定不同浓度的过氧化氢对反应速率的影响,需要测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少;
③测定相同时间内产生氧气的体积多少,保证催化剂的浓度应相同,故加入硫酸铁溶液体积不变,溶液总体积不变,都为40mL,通过改变过氧化氢和水二者体积,根据相同时间内生成氧气的体积说明不同H2O2浓度对反应速率影响;
④化学反应速率等于变化的浓度除以变化的时间;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动.
解答 解:(1)①过氧化氢在硫酸铁作催化剂条件下分解生成水与氧气,
故答案为:2H2O2 $\frac{\underline{\;Fe_{2}(SO_{4})_{3}\;}}{\;}$2H2O+O2↑;
②反应速率表示单位时间内物质的量浓度变化量,测定不同浓度的过氧化氢对反应速率的影响,需要测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少,
故答案为:相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少;
③测定相同时间内产生氧气的体积多少,保证催化剂的浓度应相同,故加入硫酸铁溶液体积不变,溶液总体积不变,都为40mL,通过改变过氧化氢和水二者体积,根据相同时间内生成氧气的体积说明不同H2O2浓度对反应速率影响,
故答案为:24.5mL;
④30%的H2O2的密度为1.13g/mL溶液的浓度为7.5mol/L,则反应速率=7.5/2=3.75mol?L-1?min-1,
故答案为:3.75mol?L-1?min-1;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深;2NO2(红棕色)?N2O4(无色),△H<0是放热反应,且双氧水的分解反应也是放热反应.当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆反应方向移动,即向生成NO2移动,故B瓶颜色更深.
点评 本题考查氧化还原反应、反应速率影响因素实验、化学反应速率计算、化学平衡移动等,侧重对学生综合能力的考查,需要学生具备扎实的基础,注意利用控制变量法测定外界条件对反应速率的影响,难度中等.

| A. | 3.2g | B. | 6.4g | C. | 9.6g | D. | 12.8g |
 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
| A. | 氮气的电子式: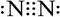 | B. | 镁离子的结构示意图: | ||
| C. | 中子数为16的磷原子:${\;}_{16}^{31}$P | D. | 丙烯的结构简式:CH3CHCH2 |
| A. | 烃的相对分子量均为奇数 | |
| B. | 硝基化合物的相对分子量均是偶数 | |
| C. | 烃及烃的含氧衍生物的相对分子量均为偶数 | |
| D. | 酚、醛、氨基酸、酯的相对分子量均为奇数 |
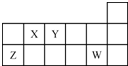
| A. | 原子半径的大小顺序:rZ>rY>rX | |
| B. | Y的简单氢化物水溶液呈酸性 | |
| C. | Y的氢化物与W的氢化物不能发生反应 | |
| D. | X、Y、Z、W四种元素的最高价氧化物对应水化物均能与强碱反应 |

(1)按如图所示装置组装好仪器,并检查装置气密性;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中不再有气泡产生时将装置中(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是生成的CO2和H2O(g)全部排入乙、丙装置.
(2)某同学认为上述实验中存在一个缺陷,该缺陷是未考虑空气中的水蒸气和二氧化碳对实验的影响.
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如下:

已知:25℃时
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀的pH | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解.