题目内容
8.实验室用铅蓄电池作电源对外供电.已知铅蓄电池放电时发生的电极反应如下:负极:Pb+SO42--2e-=PbSO4;正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O.反应过程中生成的PbSO4由于不溶于水,附着在铅电极或二氧化铅电极上.若实验前铅蓄电池的正、负极质量相等,当电路中通过0.4mol电子时,铅蓄电池两极的质量差等于( )| A. | 3.2g | B. | 6.4g | C. | 9.6g | D. | 12.8g |
分析 负极、正极均生成PbSO4附着在电极上,电极质量均增重,铅蓄电池两极的质量差等于电极质量增重之差,由组成差量可知,负极增重为SO42-的质量,而正极增重相当于SO2的质量,结合电子转移守恒计算.
解答 解:负极、正极均生成PbSO4附着在电极上,电极质量均增重,当电路中通过0.4mol电子时,
负极:Pb+SO42--2e-=PbSO4,负极电极增重相当于0.2molSO42-的质量,
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,正极增重相当于0.2molSO2的质量,
故铅蓄电池两极的质量差等于0.2mol×(96g/mol-64g/mol)=6.4g,
故选:B.
点评 本题考查电化学有关计算,侧重考查学生的分析计算能力,注意利用差量法与电子转移守恒进行计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.分类法是研究化学的一种重要方法,下列物质归类有错的是( )
| A. | 氧化性酸:HNO3、H3PO4、HClO4 | |
| B. | 干燥剂:碱石灰、硅胶、无水氯化钙 | |
| C. | 酸性氧化物:SiO2、Cl2O、CrO3 | |
| D. | 危险化学品:天然气、金属钠、氯酸钾 |
16.下列各化合物的命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. | 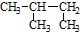 2-甲基丁烷 2-甲基丁烷 |
3.一定温度下,在密闭容器中充入一定量的CO2和H2O(g),发生反应:CO2(g)+2H2O(g)$?_{△}^{催化剂}$CH4(g)+2O2(g),测定的部分实验数据如下:
下列说法不正确的是( )
| t/s | 0 | 500 | 1000 |
| C(H2O)/mol•L-1 | 5.00 | 3.52 | 2.48 |
| C(CO2)/mol•L-1 | 2.50 |
| A. | 在500s内用H2O(g)表示的化学反应速率是2.96×10-3mol•L-1•s-1 | |
| B. | 在500s时生成的CH4的浓度是0.74mol•L-1 | |
| C. | 在1000s时反应达到平衡 | |
| D. | 0-500s的平均反应速率大于500~1000s的平均反应速率 |
6.H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.
(1)某化学活动小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.所用试剂:30%H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水.
①写出实验中H2O2分解反应方程式:2H2O2$\frac{\underline{\;Fe_{2}(SO_{4})_{3}\;}}{\;}$2H2O+O2↑.
②设计实验方案:在不同H2O2浓度下,测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少(要求所测得的数据能直接体现反应速率大小).
③根据上述实验要求,请将表格补充完整.
④查阅资料,30%的H2O2的密度为1.13g/mL,若实验测得实验2中H2O2全部分解所需的时间为2min,则用H2O2表示该反应在2min内的平均速率为3.75mol?L-1?min-1(设溶液体积变化忽略不计)
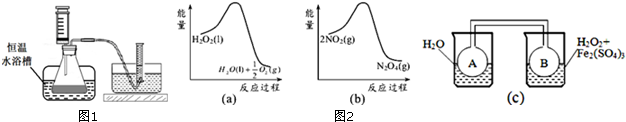
(2)利用图2-(a)和(b)中的信息,按图(c)装置(连接的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是由图(a)可知H2O2分解为放热反应,H2O2分解使B瓶中温度升高,再由图(b)可知反应2NO2(g) N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.
N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.
(1)某化学活动小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.所用试剂:30%H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水.
①写出实验中H2O2分解反应方程式:2H2O2$\frac{\underline{\;Fe_{2}(SO_{4})_{3}\;}}{\;}$2H2O+O2↑.
②设计实验方案:在不同H2O2浓度下,测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少(要求所测得的数据能直接体现反应速率大小).
③根据上述实验要求,请将表格补充完整.
物理量 实验序号 | 0.1mol?L-1Fe2(SO4)3 的体积/mL | 30% H2O2 的体积/mL | H2O 的体积/mL |
| 1 | 0.5 | 15 | 24.5mL |
| 2 | 0.5 | 30 | 9.5 |
(2)利用图2-(a)和(b)中的信息,按图(c)装置(连接的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是由图(a)可知H2O2分解为放热反应,H2O2分解使B瓶中温度升高,再由图(b)可知反应2NO2(g)
 N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.
N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.
4.W、X、Y、Z是原子序数依次增大的短周期主族元素.W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍.下列说法正确的是( )
| A. | 四种元素的最简单气态氢化物中W的沸点最高 | |
| B. | W、X、Y、Z的简单阴离子都会促进水的电离 | |
| C. | 原子的半径:Y>Z>W>X | |
| D. | YX2、YX3通入BaCl2溶液中均有白色沉淀生成 |
 .
. 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.