题目内容
14.苯乙烷(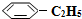 )可生产塑料单体苯乙烯(
)可生产塑料单体苯乙烯(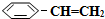 ),其原理反应是:
),其原理反应是: (g)?
(g)?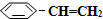 (g)+H2(g)△H=+125kJ•mol-1.
(g)+H2(g)△H=+125kJ•mol-1.某温度下,将0.40mol
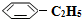 (g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
n(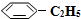 )/mol )/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(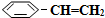 )/mol )/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)工业上常以高温水蒸气作为反应体系的稀释剂(不参与反应).
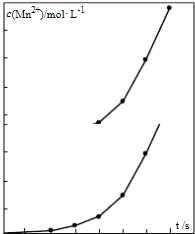
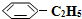 (g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将越大(填“越大”、“越小”或“不变”),原因是体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动
(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将越大(填“越大”、“越小”或“不变”),原因是体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动(3)在相同条件下,若最初向该容器中充入
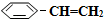 (g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下
(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下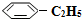 (g)和
(g)和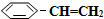 (g)的浓度c随时间t变化的曲线.
(g)的浓度c随时间t变化的曲线.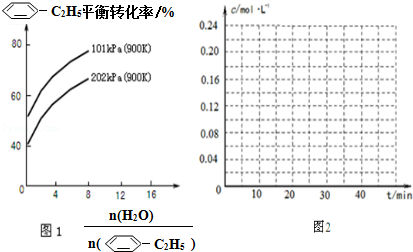
分析 (1)20min时参加反应的苯乙烷为0.4mol-0.26mol=0.14mol,而△n(苯乙烯)=△n(乙苯);
(2)体系总压强不变时,加入水蒸气稀释,反应体系的分压减小,故平衡向气体体积增大的方向移动;
(3)与原平衡为完全等效平衡,则苯乙烯、氢气的起始物质的量为0.4mol,起始浓度为0.2mol/L,平衡时,随反应进行苯乙烯浓度减小、乙苯浓度增大,40min到达平衡时,苯乙烯为$\frac{0.16mol}{2L}$=0.08mol/L,乙苯浓度为$\frac{(0.4-0.16)mol}{2L}$=0.12mol/L.
解答 解:(1)20min时参加反应的苯乙烷为0.4mol-0.26mol=0.14mol,而△n(苯乙烯)=△n(乙苯)=0.15mol,
故答案为:0.14;
(2)体系总压强不变时,加入水蒸气稀释,反应体系的分压减小,故平衡向气体体积增大的方向移动,乙苯的平衡转化率将越大,
故答案为:越大;体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动;
(3)与原平衡为完全等效平衡,则苯乙烯、氢气的起始物质的量为0.4mol,起始浓度为0.2mol/L,平衡时,随反应进行苯乙烯浓度减小、乙苯浓度增大,40min到达平衡时,苯乙烯为$\frac{0.16mol}{2L}$=0.08mol/L,乙苯浓度为$\frac{(0.4-0.16)mol}{2L}$=0.12mol/L,乙苯、苯乙烯的浓度c随时间t变化的曲线为: ,
,
故答案为: .
.
点评 本题考查化学平衡计算与影响因素、化学平衡图象等问题,题目难度中等,(2)为易错点为,注意水蒸气产生的分压对化学平衡的影响.

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
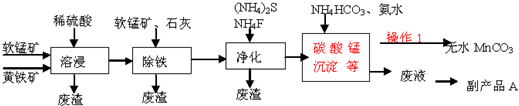
4.碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)为主要原料制备碳酸锰(MnCO3难溶,分解温度较高)的一种工艺流程如图:
已知:几种金属离子沉淀的pH如表:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.加压 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+═2Fe3++15Mn2++4SO42ˉ+14H2O
(3)操作1经过滤、洗涤(填操作名称)烘干等过程可得到无水碳酸锰.
(4)①除铁工序中,先加入适量的软锰矿,其作用是除去可能未被完全氧化的Fe2+,如何检验溶液中的Fe2+已被完全氧化?加入酸性高锰酸钾溶液,观察是否褪色
②再加入石灰调节溶液pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
(6)黄铁矿(主要成分是FeS2)还可以用来制备化工原料FeSO4,FeSO4可转化为FeCO3,
FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
C(s)+O2(g)═CO2(g)△H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.

已知:几种金属离子沉淀的pH如表:
| Fe2+ | Fe3+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 10.4 |
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.加压 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+═2Fe3++15Mn2++4SO42ˉ+14H2O
(3)操作1经过滤、洗涤(填操作名称)烘干等过程可得到无水碳酸锰.
(4)①除铁工序中,先加入适量的软锰矿,其作用是除去可能未被完全氧化的Fe2+,如何检验溶液中的Fe2+已被完全氧化?加入酸性高锰酸钾溶液,观察是否褪色
②再加入石灰调节溶液pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
(6)黄铁矿(主要成分是FeS2)还可以用来制备化工原料FeSO4,FeSO4可转化为FeCO3,
FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
C(s)+O2(g)═CO2(g)△H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.
5.下列说法中正确的是( )
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 用可见光束照射以区别溶液和胶体 | |
| C. | Na2O、Fe2O3、Al2O3都是碱性氧化物 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
2.下列有关离子方程式,正确的是( )
| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3?↑+CO32-+2H2O | |
| C. | 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
9.下列实验方案设计中,能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 验证二氧化硫漂白性 | 二氧化硫通入溴水中,看溶液颜色是否褪色 |
| B | 检验氯化铁溶液中是否含FeCl2 | 向氯化铁溶液中滴加氢氧化钠溶液 |
| C | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀粉溶液,观察溶液是否变蓝 |
| D | 验证Ksp(AgI)>Ksp(AgCl) | 向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液,观察沉淀颜色 |
| A. | A | B. | B | C. | C | D. | D |
3.下列指定反应的离子方程式正确的是( )
| A. | 硫代硫酸钠溶液与稀硫酸混合:S2O32-+2H+═S↓+SO2↑+H2O | |
| B. | 向CuSO4溶液中通入H2S气体:Cu2++S2-═CuS↓ | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S↓+2Cl- | |
| D. | 重铬酸钾的溶液中存在着如下平衡:Cr2O72-(橙红色)+H2O═2H++2CrO42-(黄色) |
4.下列离子方程式书写正确的是( )
| A. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| B. | 铁钉放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 将稀硫酸滴入氢氧化钡溶液中:Ba2++SO42-═BaSO4↓ |