题目内容
含有A、B、C三支均盛有2mL0.5mol/L明矾[KAl(SO4)2?12H2O]溶液(均滴加有3滴石蕊试液),现分别向三支试管中加入相应的试剂.
(1)填写下表.
(2)C中反应的离子方程式 ,B中pH 7.
(1)填写下表.
| A | B | C | |
| 操作 | 3滴0.1mol/LH2SO4溶液 | 1mL1.5mol/LNa2CO3溶液 | 2mL1mol/LBa(OH)2溶液 |
| 现象 |
考点:镁、铝的重要化合物
专题:元素及其化合物
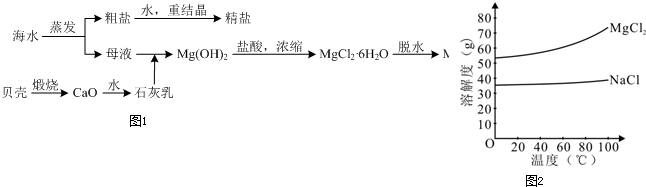
分析:明矾属于强酸弱碱盐,溶液呈酸性,加入硫酸后会导致溶液酸性增强,红色加深; 加入Na2CO3后,Al3+与CO32-恰好发生双水解反应消耗完,溶液呈中性变紫色;加入Ba(OH)2后,生成白色BaSO4沉淀及AlO2-,因溶液此时呈碱性,故溶液变蓝色.
解答:
解:(1)明矾属于强酸弱碱盐,溶液呈酸性,加入硫酸后会导致溶液酸性增强,红色加深; 加入Na2CO3后,Al3+与CO32-恰好发生双水解反应消耗完,溶液呈中性变紫色;加入Ba(OH)2后,生成白色BaSO4沉淀及AlO2-,因溶液此时呈碱性,故溶液变蓝色,故答案为:
(2)根据以上分析,C中反应的离子方程式Al3++4OH-+2Ba2++2SO42-=2BaSO4↓+AlO2-+2H2O;B中Al3+与CO32-恰好发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,所以溶液成中性,故答案为:Al3++4OH-+2Ba2++2SO42-=2BaSO4↓+AlO2-+2H2O;=;
| A | B | ||
| 操作 | |||
| 现象 | 溶液的红色略有加深 | 有白色沉淀及气体生成,溶液呈紫色 | 溶液变蓝色,有白色沉淀生成 |
点评:本题综合性强,不仅需掌握硫酸钡是难溶于碱的盐,还需掌握氢氧化铝的两性,掌握怎样根据物质的量的关系分析反应过程是解题的关键.

练习册系列答案
相关题目
a mol 和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成CO2、H2O(气)、N2.在相同条件下它们的体积比为12:8:1,则a:b为( )
和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成CO2、H2O(气)、N2.在相同条件下它们的体积比为12:8:1,则a:b为( )
 和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成CO2、H2O(气)、N2.在相同条件下它们的体积比为12:8:1,则a:b为( )
和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成CO2、H2O(气)、N2.在相同条件下它们的体积比为12:8:1,则a:b为( )| A、1:1 | B、1:2 |
| C、2:3 | D、3:2 |
生活中常用到一些化学知识,下列分析中正确的是( )
| A、天然药物无毒副作用,所以,多多益善 |
| B、氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性 |
| C、酸雨指pH值小于7的降水 |
| D、误食重金属盐会中毒,是因为重金属盐能使蛋白质盐析 |
下列说法正确的是( )
| A、将少量的CO2气体通入足量次氯酸钠溶液中的离子方程式为:ClO+CO2+H2O═HCO3-+HClO,可得出电离平衡常数K1(H2CO3)>K(HClO)>K2(H2CO3) |
| B、已知Ag2CrO4的Ksp为1.12×10-12,则将等体积的1.0×10-3 mol?L-1的AgNO3溶液和1.0×10-3 mol?L-1的K2CrO4溶液混合,不会有沉淀生成 |
| C、相同物质的量浓度的下列溶液:①NH4HS O4 ②NH4Cl ③NH3?H2O,水电离程度由大到小的顺序是:①>②>③ |
| D、在0.1mol?L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
天宫一号搭载的长征二号火箭使用的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4=3N2+4H2O+2CO2,下列叙述错误的是( )
| A、此反应可在瞬间产生大量高温气体,推动火箭飞行 |
| B、此反应是氧化还原反应,N2O4是氧化剂 |
| C、每生成1mol N2,该反应转移电子8mol |
| D、此反应中R的分子式为C2H8N2 |
下列反应既属于化合反应又属于氧化还原反应的是( )
| A、SO2+H2O═H2SO3 | ||||
B、C+CO2
| ||||
C、H2+CuO
| ||||
D、CaCO3
|
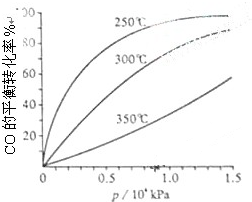 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.