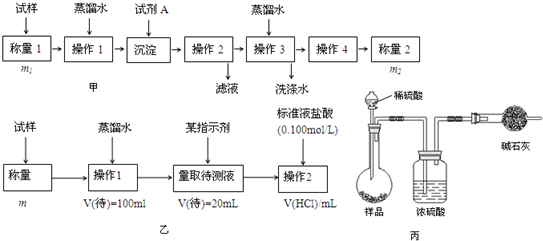
��Ŀ����
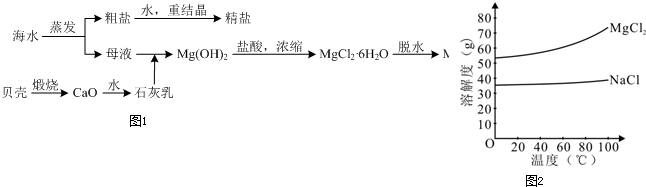
�ú�ˮ��ͬʱ�����Ȼ��ƺͽ���þ��þ�Ļ������������ͼ1��ʾ��
��1����ʵ�������ɴ��Ρ��ؽᾧ���ƾ��εIJ��������ܽ⡢������ ��ϴ�ӵȲ��裻�й����С����������������������� ��
a��������Ŀ���ǵõ��ȱ�����Һ
b��������Ŀ������������
c��Ӧ������������Һ
d��Ӧ�������н϶ྦྷ������ʱΪֹ
��2����MgCl2��Һ�õ�MgCl2?6H2OҲ��Ҫ�����������ܽ����ͼ2���ߣ�������Ŀ����
a���õ��ȱ�����Һ b����������
��3�����ڿ����м���MgCl2?6H2O�����ɵ���Mg��OH�� Cl��д����Ӧ�Ļ�ѧ����ʽ�� ���õ�ⷨ��ȡ����þʱ����Ҫ��ˮ�Ȼ�þ���ڸ����HCl�����м���MgCl2?6H2Oʱ���ܵõ���ˮMgCl2����ԭ����
��4�������̲����������У���Ca2+�ܱ��������������⣬�����ۺ����õ�������
��5��MgCl2�ɵ����Mg��MgO������Ҫ���ͻ���ϣ���550��ʱ��MgCl2?6H2O��ֽ�����MgO��MgCl2��HCl��ˮ��������������ԭ�ϣ�ʹһ������MgCl2?6H2Oȫ������a mol MgO��b mol MgCl2��36.5%�����ᣬ�� a��b�� ��ȡ����ֵ����

��1����ʵ�������ɴ��Ρ��ؽᾧ���ƾ��εIJ��������ܽ⡢������
a��������Ŀ���ǵõ��ȱ�����Һ
b��������Ŀ������������
c��Ӧ������������Һ
d��Ӧ�������н϶ྦྷ������ʱΪֹ
��2����MgCl2��Һ�õ�MgCl2?6H2OҲ��Ҫ�����������ܽ����ͼ2���ߣ�������Ŀ����
a���õ��ȱ�����Һ b����������
��3�����ڿ����м���MgCl2?6H2O�����ɵ���Mg��OH�� Cl��д����Ӧ�Ļ�ѧ����ʽ��
��4�������̲����������У���Ca2+�ܱ��������������⣬�����ۺ����õ�������
��5��MgCl2�ɵ����Mg��MgO������Ҫ���ͻ���ϣ���550��ʱ��MgCl2?6H2O��ֽ�����MgO��MgCl2��HCl��ˮ��������������ԭ�ϣ�ʹһ������MgCl2?6H2Oȫ������a mol MgO��b mol MgCl2��36.5%�����ᣬ�� a��b��
���㣺��ˮ��Դ�����ۺ�����,�����ᴿ
ר�⣺�����������Ԫ��
�����������к���CaCO3�����ձ��ǵõ�CaO�������ķ�ӦΪCaCO3
CO2��+CaO��CaO��ˮ������ӦCaO+H2O=Ca��OH��2�õ�ʯ���飻��ˮͨ�������õ����κ�ĸҺ������ͨ���ܽ⡢�ؽᾧ�õ����Σ���ʯ�������ĸҺ�з�����ӦCa��OH��2+MgCl2=Mg��OH��2+CaCl2����Mg��OH��2����ϡ�����У�������ӦMg��OH��2+2HCl=MgCl2+2H2O��Ȼ��Ũ���õ�MgCl2.6H2O����MgCl2.6H2O��HCl��Χ�м��ȵõ�MgCl2���ٽ����Ŀ�������
| ||
���
�⣺�����к���CaCO3�����ձ��ǵõ�CaO�������ķ�ӦΪCaCO3
CO2��+CaO��CaO��ˮ������ӦCaO+H2O=Ca��OH��2�õ�ʯ���飻��ˮͨ�������õ����κ�ĸҺ������ͨ���ܽ⡢�ؽᾧ�õ����Σ���ʯ�������ĸҺ�з�����ӦCa��OH��2+MgCl2=Mg��OH��2+CaCl2����Mg��OH��2����ϡ�����У�������Ӧ Mg��OH��2+2HCl=MgCl2+2H2O��Ȼ��Ũ���õ�MgCl2.6H2O����MgCl2.6H2O��HCl��Χ�м��ȵõ�MgCl2��
��1����ʵ�������ɴ��Ρ��ؽᾧ���ƾ��εIJ��������ܽ⡢���������ˡ�ϴ�ӵȲ��裻
a���Ȼ��Ƶ��ܽ�����¶�Ӱ�첻������������Ŀ�����������壬�ʴ���
b������a֪��������Ŀ�����������壬����ȷ��
c����Ϊ��Һ�к��д������ʣ����Բ���������Һ���ʴ���
d��Ӧ�������н϶ྦྷ������ʱΪֹ����Ϊ��Һ�к��д������ʣ����Բ���������Һ������õ�����Ȼ�ǻ�������ȷ��
��ѡac��
�ʴ�Ϊ�����ˣ�ac��
��2����MgCl2��Һ�õ�MgCl2?6H2OҲ��Ҫ�����������ܽ����ͼ2���ߣ�������Ŀ���ǵõ��ȵı�����Һ��Ȼ����ȴ�õ�MgCl2?6H2O����ѡa��
��3�����ڿ����м���MgCl2?6H2O�����ɵ���Mg��OH��Cl�����ݷ�Ӧ������P��Ӧ����֪���÷�Ӧ�Ļ�ѧ����ʽ��MgCl2.6H2O=Mg��OH��Cl+HCl��+5H2O��MgCl2��ˮ������������þ��HCl�������¶ȴٽ�ˮ�⣬���Եò����Ȼ�þ���õ�������þ��Ϊ����ˮ�⣬��Ҫ�ڸ����HCl�����м���MgCl2?6H2O���õ�MgCl2��
�ʴ�Ϊ��MgCl2.6H2O=Mg��OH��Cl+HCl��+5H2O���ڸ����HCl����������MgCl2ˮ�⣬�Ҵ���MgCl2.6H2O���Ȳ�����ˮ���������ܵõ���ˮ�Ȼ�þ��
��4�������̲����������У���Ca2+�ܱ��������������⣬��������Ȼ�þ�õ�þ�����������Ի����ۺ����õ��������������ʴ�Ϊ��������
��5��������1molMgCl2?6H2O������Ӧ������Mgԭ���غ��a+b=1mol�٣����������=1mol��203g/mol-amol��40g/mol-bmol��95g/mol=��203-40a-95b��g��HCl�����ʵ���=
=[��203-40a-95b����1%]mol������Clԭ���غ��2mol=[2b+0.01����203-40a-95b��]mol�ڣ�
�����٢ڵ�
������a��b=
��
=3��1��
�ʴ�Ϊ��3��1��
| ||
��1����ʵ�������ɴ��Ρ��ؽᾧ���ƾ��εIJ��������ܽ⡢���������ˡ�ϴ�ӵȲ��裻
a���Ȼ��Ƶ��ܽ�����¶�Ӱ�첻������������Ŀ�����������壬�ʴ���
b������a֪��������Ŀ�����������壬����ȷ��
c����Ϊ��Һ�к��д������ʣ����Բ���������Һ���ʴ���
d��Ӧ�������н϶ྦྷ������ʱΪֹ����Ϊ��Һ�к��д������ʣ����Բ���������Һ������õ�����Ȼ�ǻ�������ȷ��
��ѡac��
�ʴ�Ϊ�����ˣ�ac��
��2����MgCl2��Һ�õ�MgCl2?6H2OҲ��Ҫ�����������ܽ����ͼ2���ߣ�������Ŀ���ǵõ��ȵı�����Һ��Ȼ����ȴ�õ�MgCl2?6H2O����ѡa��
��3�����ڿ����м���MgCl2?6H2O�����ɵ���Mg��OH��Cl�����ݷ�Ӧ������P��Ӧ����֪���÷�Ӧ�Ļ�ѧ����ʽ��MgCl2.6H2O=Mg��OH��Cl+HCl��+5H2O��MgCl2��ˮ������������þ��HCl�������¶ȴٽ�ˮ�⣬���Եò����Ȼ�þ���õ�������þ��Ϊ����ˮ�⣬��Ҫ�ڸ����HCl�����м���MgCl2?6H2O���õ�MgCl2��
�ʴ�Ϊ��MgCl2.6H2O=Mg��OH��Cl+HCl��+5H2O���ڸ����HCl����������MgCl2ˮ�⣬�Ҵ���MgCl2.6H2O���Ȳ�����ˮ���������ܵõ���ˮ�Ȼ�þ��
��4�������̲����������У���Ca2+�ܱ��������������⣬��������Ȼ�þ�õ�þ�����������Ի����ۺ����õ��������������ʴ�Ϊ��������
��5��������1molMgCl2?6H2O������Ӧ������Mgԭ���غ��a+b=1mol�٣����������=1mol��203g/mol-amol��40g/mol-bmol��95g/mol=��203-40a-95b��g��HCl�����ʵ���=
| (203-40a-95b)g��36.5% |
| 36.5g/mol |
�����٢ڵ�
|
| 108 |
| 145 |
| 37 |
| 145 |
�ʴ�Ϊ��3��1��
���������⿼�麣ˮ��Դ�ۺ����ã��漰�����ᴿ������ұ��������ˮ�⡢���ʵ����ļ��㣬���ؿ���ѧ������������������֪������������ǿ�������ұ�������Ĺ�ϵ���ѵ��ǣ�5������㣬Ҫ����ԭ���غ���м��㣬��Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
2SO2��g��+O2��g��?2SO3��g���ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2L�ĺ����ܱ�������Ͷ��SO2��g����O2��g��������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ�������ж��У���ȷ���ǣ�������
| �� | �� | �� | ||
| ��ʼ���ʵ��� | n��SO2��/mol | 0.4 | 0.8 | 0.8 |
| n��O2��/mol | 0.24 | 0.24 | 0.48 | |
| SO2��ƽ��ת����/% | 80 | ��1 | ��2 | |
| A�����з�Ӧ��ƽ�ⳣ��С���� |
| B�����¶��£�ƽ�ⳣ��ֵΪ400 |
| C��ƽ��ʱ������c��SO3���Ǽ��е�2�� |
| D��ƽ��ʱ������O2��ת���ʴ�������O2��ת���� |
��9.60��10-4 mol ��XO4-����Һ�л�ԭ���ϵͼ�̬������24mL 0.100mol/L ��H2O2��Һ����XԪ�صĻ��ϼ۱�Ϊ��������
| A��+1 | B��+2 | C��+3 | D��+4 |
���з�Ӧ��ˮ����ԭ�����ǣ�������
| A��2Na+2H2O=H2��+2NaOH |
| B��Cl2+NaOH=NaCl+NaClO+H2O |
| C��SO2+Cl2+2H2O=2HCl+H2SO4 |
| D��2F2+2H2O=4HF+O2 |
����˵����ȷ���ǣ�������
| A��CHCl3������������ |
| B��H2O��������ԭ��Ϊsp2�ӻ�������Ӽ��ι���ΪV�� |
| C��������̼��̼ԭ��Ϊsp�ӻ���Ϊֱ���η��� |
| D��NH4+�������� |