题目内容
14.已知物质A~I之间的转化关系符合如图所示,其中A、C、F、G、I为常见固体且其焰色反应均为黄色,A为海水中主要溶质,B为常温下常见液体,E为黄绿色气体,H能使澄清石灰水变浑浊,其余物质通常状况下均为气体.
试回答下列问题:
(1)写出下列物质的化学式:ANaClECl2FNaHCO3 HCO2
(2)完成反应②离子方程式:Cl2+2OH-=Cl-+ClO-+H2O反应③化学方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
分析 A、C、F、G、I为常见固体且焰色反应均为黄色,说明均有钠元素,A为海水中主要溶质,则A为NaCl,B为常温下常见液体,则B为H2O;E为黄绿色气体,则E为Cl2,H能使澄清石灰水变浑浊的气体,则H为CO2,根据题中各物质转化关系,电解食盐水得C、D、E,C中含有钠元素,则C为NaOH,则D为H2,C与E反应生成A、I、B,则I为NaClO,NaOH和过量二氧化碳反应生成的F为NaHCO3,加热反应生成的G为Na2CO3,以此解答该题.
解答 解:A、C、F、G、I为常见固体且焰色反应均为黄色,说明均有钠元素,A为海水中主要溶质,则A为NaCl,B为常温下常见液体,则B为H2O;E为黄绿色气体,则E为Cl2,H能使澄清石灰水变浑浊的气体,则H为CO2,根据题中各物质转化关系,电解食盐水得C、D、E,C中含有钠元素,则C为NaOH,则D为H2,C与E反应生成A、I、B,则I为NaClO,NaOH和过量二氧化碳反应生成的F为NaHCO3,加热反应生成的G为Na2CO3,
(1)由以上分析可知A为NaCl,E为Cl2,F为NaHCO3,H为CO2,故答案为:NaCl;Cl2;NaHCO3;CO2;
(2)反应②为氯气与氢氧化钠的反应,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
反应③NaHCO3加热反应生成Na2CO3、水和二氧化碳,方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
点评 本题考查的是物质的推断、化学方程式的书写,为高考常见题型,属于综合知识的考查,难度中等,主要涉及钠、氯及其化合物等,掌握物质的存在、颜色、常见性质是解题的关键.

| A. | CaCl2 | B. | Ca(OH)2 | C. | 饱和Na2CO3溶液 | D. | Ca(ClO)2 |

| A. | 该硫酸的物质的量浓度为1.84mol/L | |
| B. | 若 Zn与该硫酸反应消耗13克Zn,一定产生4.48升气体 | |
| C. | 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL | |
| D. | 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L |
| A. | 9g D2O中含有的电子数为5NA | |
| B. | 标准状况下,11.2 L Br2所含的分子数为0.5NA | |
| C. | 7.1g Cl2与足量NaOH溶液反应转移的电子数为0.2NA | |
| D. | 0.1mol CH4所含的电子数为1NA |
| A. | 元素是具有相同核电荷数的同一类原子的总称 | |
| B. | 核素代表一类原子 | |
| C. | 某元素的一种核素代表该元素的一种原子 | |
| D. | 某种同位素或核素代表该元素的一种原子 |
| A. | 2L 1mol/L Na2SO4溶液中离子总数为3NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的原子数为3NA | |
| D. | 78g Na2O2与足量水充分反应时电子转移数为NA |
| A. | 胶体和溶液、悬浊液的本质区别是它们分散质粒子的大小 | |
| B. | 光线透过胶体时,胶体发生丁达尔效应 | |
| C. | 布朗运动是胶体粒子特有的运动形式,可以据此把胶体和溶液、悬浊液区别开来 | |
| D. | Fe(OH)3胶体粒子具有较大的表面积,能吸附阳离子,故在电场作用下会定向移动 |
| A. | 0.02 mol/L | B. | 0.05 mol/L | C. | 1 mol/L | D. | 2mol/L |
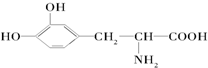 .这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究结果.L多巴分子中不含有的官能团是( )
.这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究结果.L多巴分子中不含有的官能团是( )