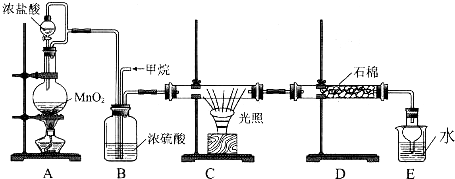
题目内容
9.在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3②Na2CO3③KCl④CuCl2⑤NaHCO3可以得到相应盐的晶体(可以含有结晶水)的是( )| A. | ①③⑤ | B. | ①②③ | C. | ②④ | D. | ①③④⑤ |
分析 加热盐溶液,可以得到相应盐的晶体,则说明在加热过程中盐性质温度,不分解,如盐发生水解的话,水解生成的酸为难挥发性酸,以此解答该题.
解答 解:①Fe2(SO4)3加热时虽发生水解,但硫酸难挥发,加入溶液可生成Fe2(SO4)3,故正确;
②Na2CO3水解生成氢氧化钠,但氢氧化钠不稳定,在空气中仍生成碳酸钠,故正确;
③KCl性质稳定,加入溶液可生成KCl,故正确;
④CuCl2溶液水解生成氢氧化铜和盐酸,盐酸挥发,最后生成氢氧化铜,故错误;
⑤NaHCO3不稳定,加热分解生成碳酸钠,故错误.
故选B.
点评 本题考查盐类的水解以及元素化合物知识,侧重于学生的分析能力和基本理论知识的理解和运用的考查,注意把握盐类水解的原理、规律和应用,难度不大.

练习册系列答案
相关题目
14.用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
| A. | 干燥的 | B. | 不漏水的 | ||
| C. | 用欲配制的溶液润洗过的 | D. | 标有刻度的 |
1.在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)?3C(g)+D(s),达到平衡时,C的浓度为1.2mol/L.若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol/L,则D的起始物质的量应满足的条件应是( )
| A. | 大于0.6mol | B. | 大于零 | C. | 等于1mol | D. | 任意值 |
18.下列有关离子的检验,正确的是( )
| A. | 某化合物焰色反应呈黄色,说明该物质中一定含有Na+ | |
| B. | 向某溶液中加入盐酸有气泡产生,说明一定有CO32- | |
| C. | 向某溶液中加入氯化钡溶液,有白色沉淀产生,说明一定有SO42- | |
| D. | 向某溶液中加入硝酸银溶液,有白色沉淀产生,说明一定有Cl- |
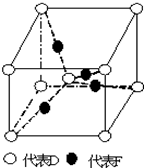 在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的$\frac{1}{4}$,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的$\frac{1}{4}$,F元素位于周期表的ds区,其基态原子最外能层只有一个电子. .
.