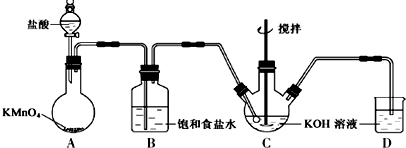
题目内容
4.已知在碱性溶液中可发生如下反应:R(OH)3+2C1O-+4OH-═RO4n-+3Cl-+5H2O.则RO4 n- 中R的化合价是( )| A. | +7 | B. | +6 | C. | +5 | D. | +4 |
分析 R(OH)3+2C1O-+4OH-═RO4n-+3Cl-+5H2O中遵循电荷守恒,可知n=3,然后结合离子中正负化合价的代数和为-3计算.
解答 解:R(OH)3+2C1O-+4OH-═RO4n-+3Cl-+5H2O中,由电荷守恒可知,反应前的负电荷总数为2+4=6,由电荷守恒可知,n+3=6,则n=3,RO4 n- 中R的化合价为x,则x+(-2)×4=-3,解得x=+5
故选C.
点评 本题考查氧化还原反应,为高频考点,把握电荷守恒为解答的关键,侧重分析与应用能力的考查,注意反应前后离子电荷的判断,题目难度不大.

练习册系列答案
相关题目
14.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:

实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热A,回流50min.反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)仪器B的名称是球形冷凝管.
(2)在洗涤操作中,第一次水洗的主要目的是洗掉大部分硫酸和醋酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是提高醇的转化率.
(5)实验中加入少量无水MgSO4的目的是干燥.
(6)在蒸馏操作中,仪器选择及安装都正确的是b(填标号).
(7)本实验的产率是c(填标号).
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏高(填“高”或“低”),其原因是会收集少量未反应的异戊醇.

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热A,回流50min.反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)仪器B的名称是球形冷凝管.
(2)在洗涤操作中,第一次水洗的主要目的是洗掉大部分硫酸和醋酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是提高醇的转化率.
(5)实验中加入少量无水MgSO4的目的是干燥.
(6)在蒸馏操作中,仪器选择及安装都正确的是b(填标号).
(7)本实验的产率是c(填标号).
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏高(填“高”或“低”),其原因是会收集少量未反应的异戊醇.

12.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)$\frac{\underline{\;高温\;}}{\;}$2Fe(s)+3CO2(g)△H=a kJ•mol-1.
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1;
②C(s,石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1.则a=-28.5.
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为60%.
②下列说法正确的是ad(填字母).
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2:3
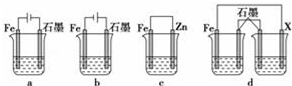
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.
①在a、b、c装置中能保护铁的是bc(填字母).
②若用d装置保护铁,X极的电极材料应是锌(填名称).
(5)25℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39.25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.215×1021.
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1;
②C(s,石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1.则a=-28.5.
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是ad(填字母).
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2:3
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.
①在a、b、c装置中能保护铁的是bc(填字母).
②若用d装置保护铁,X极的电极材料应是锌(填名称).

(5)25℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39.25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.215×1021.
19.下列物质中,既有离子键,又含有共价键的物质是( )
| A. | H2SO4 | B. | CO2 | C. | NaOH | D. | HNO3 |
9.在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3②Na2CO3③KCl④CuCl2⑤NaHCO3可以得到相应盐的晶体(可以含有结晶水)的是( )
| A. | ①③⑤ | B. | ①②③ | C. | ②④ | D. | ①③④⑤ |
13.下列各组混合物中,可以用分液漏斗分离的是( )
| A. | 酒精和水 | B. | 苯和乙醇 | C. | 硝基苯和水 | D. | 己烷和溴苯 |
14.下列实验操作正确的是( )


| A. | 用装置甲收集SO2 | |
| B. | 用装置乙制备AlCl3晶体 | |
| C. | 用装置丙进行中和滴定时,滴定前锥形瓶先用待装液润洗 | |
| D. | 装置丁中使用分液漏斗和容量瓶时,先要检查仪器是否漏液 |