题目内容
9.(1)与标准状况下3.36LCO2所含氧原子数目相同的水的质量是5.4g;(2)将8g NaOH溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度为0.2mol/L
(3)9.2g氮的氧化物(NOx)中含氮原子0.2mol,则x的数值为2;
(4)已知标况下某气体的密度为1.429g/L,则该气体的相对分子质量为32;
(5)实验室里需用80mL 0.1mol•L-1的硫酸铜溶液,现选取100mL容量瓶进行配制,需要胆矾的质量为2.5g.
分析 (1)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$计算;
(2)根据n=$\frac{m}{M}$计算NaOH物质的量,再根据c=$\frac{n}{V}$计算稀释为1L溶液后的浓度,溶液是均一的,取出溶液浓度与原溶液浓度相等;
(3)氧化物NOx中含有N原子数为0.2mol,则氧化物NOx的物质的量为0.2mol,根据M=$\frac{m}{n}$计算氧化物NOx的摩尔质量,进而计算x的值;
(4)根据M=ρVm计算摩尔质量,再利用摩尔质量与相对分子质量的数值相等来解答;
(5)根据n=cV计算硫酸铜的物质的量,硫酸铜的物质的量等于硫酸铜晶体的物质的量,再根据m=nM计算硫酸铜晶体的质量.
解答 解:(1)3.36LCO2的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,n(O)=2×0.15mol=0.3mol,则n(H2O)=0.3mol,m(H2O)=0.3mol×18g/mol=5.4g,
故答案为:5.4g;
(2)8g NaOH的物质的量为$\frac{8g}{40g/mol}$=0.2mol,溶解在10mL水中再稀释成1L后溶液浓度为$\frac{0.2mol}{1L}$=0.2mol/L,溶液是均一的,取出溶液浓度与原溶液浓度相等,故从稀释后溶液中取出10mL溶液的物质的量浓度为 0.2mol/L,
故答案为:0.2mol/L;
(3)氧化物NOx中含有N原子数为0.2mol,则氧化物NOx的物质的量为0.2mol,氧化物NOx的摩尔质量=$\frac{9.2g}{0.2mol}$=46g/mol,故14+16x=46,解得x=2,
故答案为:2;
(4)在标准状况下,Vm=22.4L/mol,
由M=ρVm可知,
M=1.429g/L×22.4L/mol=32g/mol,
又摩尔质量与相对分子质量的数值相等,
则该气体的相对分子质量为32,
故答案为:32;
(5)配制100mL0.1mol/LCuSO4溶液,需要CuSO4的物质的量为0.1L×0.1mol/L=0.01mol,硫酸铜的物质的量等于硫酸铜晶体的物质的量,故需要CuSO4.5H2O的质量为0.01mol×250g/mol=2.5 g,
故答案为:2.5 g.
点评 本题考查常用化学计量的有关计算,比较基础,注意对公式的理解与灵活运用.

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
| A. | 焦炭在高温下与水蒸气反应 | B. | 锌和稀硫酸反应制取氢气 | ||
| C. | 盐酸和氢氧化钠的中和反应 | D. | 氢气在氧气中燃烧 |
| A. | 苯和乙烯都能使酸性KMnO4溶液褪色 | |
| B. | 乙烯可以用向下排空气法收集 | |
| C. | 乙烷、乙醇和乙酸都可以和钠反应生成氢气 | |
| D. | 苯是比水轻,有特殊气味的无色液体 |
| A. | 溶液中c(NH${\;}_{4}^{+}$)=c(Cl-) | |
| B. | 此时水的电离程度最大 | |
| C. | 此时溶液中NH3•H2O的物质的量浓度为 $\frac{1}{2}$(a-0.01)mol/L | |
| D. | 用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
 中最多有多少个C原子共面( )
中最多有多少个C原子共面( )| A. | 6 | B. | 8 | C. | 10 | D. | 12 |
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数是原子核外电子层数的2倍 |
| X | 原子最外层电子数是次外层的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正化合价是+7价 |
(2)元素X的一种同位素可用于测定文物年代,这种同位素的符号是146C;
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b(填字母);
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物对应的水化物中,其中一种在水中电离程度明显不同于其他三种的是H2CO3(填化学式).
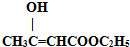 ,为了证实此平衡的存在,在乙酰乙酸乙酯中滴入几滴5%的FeCl3水溶液,此时溶液立即显紫红色,说明乙酰乙酸乙酯中确有烯醇式存在.继续滴加橙红色的Br2/CCl4溶液,至溶液几乎呈无色.下列描述最恰当的是( )
,为了证实此平衡的存在,在乙酰乙酸乙酯中滴入几滴5%的FeCl3水溶液,此时溶液立即显紫红色,说明乙酰乙酸乙酯中确有烯醇式存在.继续滴加橙红色的Br2/CCl4溶液,至溶液几乎呈无色.下列描述最恰当的是( )| A. | 溶液几乎呈无色后,片刻后又变为橙红色 | |
| B. | 溶液几乎呈无色后,颜色不再变化 | |
| C. | 溶液几乎呈无色后,片刻后又变为紫红色 | |
| D. | 溶液几乎呈无色后,片刻后又变为紫红色,然后再变成无色,再变成紫红色,循环往 |
 .
.