题目内容
18.现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数是原子核外电子层数的2倍 |
| X | 原子最外层电子数是次外层的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正化合价是+7价 |
(2)元素X的一种同位素可用于测定文物年代,这种同位素的符号是146C;
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b(填字母);
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物对应的水化物中,其中一种在水中电离程度明显不同于其他三种的是H2CO3(填化学式).
分析 短周期元素,T元素M层的电子数是原子核外电子层数的2倍,原子M层上有6个电子,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素,据此解答.
解答 解:短周期元素,T元素M层的电子数是原子核外电子层数的2倍,原子M层上有6个电子,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素,
(1)由上述分析可知,元素T为硫元素,在第三周期VIA族,故答案为:第三周期VIA族;
(2)元素C的一种同位素可用于测定文物年代,这种同位素的符号是故答案为146C,故答案为:146C;
(3)同周期随原子序数增大非金属性减弱,故非金属性较强的是Cl,氢化物越稳定,非金属性越强能证明这一事实,故答案为:Cl;b;
(4)T、X、Y、Z四种元素的最高价氧化物的水化物分别为:H2SO4、H2CO3、HNO3、HClO4,碳酸是弱酸,其它酸为强酸,碳酸明显不同于其他三种,故答案为:H2CO3.
点评 本题考查结构性质位置关系应用,难度不大,涉及元素周期律知识的应用,元素推断是解题的关键,审题要仔细,如填元素符号不能写成名称等.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | CHCl2分子的立体构型为正四面体形 | |
| B. | H2O分子中氧原子的杂化轨道类型为sp2,分子的立体构型为V形 | |
| C. | CO2分子中碳原子的杂化轨道类型为sp,分子的立体构型为直线形 | |
| D. | NH4+的立体构型为三角锥形 |
13.某金属的硝酸盐加热分解生成的NO2和O2的物质的量之比4:1.该混和气体可以使余烬的小木条复燃,由此可得出的结论合理的是( )
| A. | NO2是酸性氧化物 | B. | 加热过程中金属元素的化合价升高 | ||
| C. | NO2支持燃烧 | D. | 加热过程中金属元素的化合价降低 |
10.如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为( )
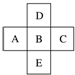

| A. | 5x+10 | B. | 5x | C. | 5x+14 | D. | 5x+16 |
7.X为下列各选项物质,X不能满足如图转化关系的是( )


| A. | H2S | B. | N2 | C. | S | D. | NH3 |
8.下列说法正确的是( )
| A. | 0.2 mol/LCH3COOH溶液加水稀释,CH3COO-数目增多c(OH-)减少 | |
| B. | 室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 | |
| C. | 某温度下,pH=11的NH3•H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3•H2O与NH3三种微粒的平衡浓度之和为0.05mol•Lˉ1 | |
| D. | pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V(盐酸)<V(氨水) |