题目内容
下列表示对应的离子方程式正确的是( )
| A、硫化钠的水解反应:S2-+H3O+?HS-+H2O |
| B、碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- |
| C、向Ba(OH)2溶液滴KHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、Na2HPO4溶于水后发生电离:Na2HPO4=2Na++HPO42- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.不符合水解的实质,硫离子应该结合水中的氢离子;
B.碳酸根离子是多元弱酸根离子分步水解;
C.不符合物质组成的配比,1molBa(OH)2电离产生2mol氢氧根离子;
D.Na2HPO4是强电解质,溶于水后完全电离.
B.碳酸根离子是多元弱酸根离子分步水解;
C.不符合物质组成的配比,1molBa(OH)2电离产生2mol氢氧根离子;
D.Na2HPO4是强电解质,溶于水后完全电离.
解答:
解:A.硫化钠的水解反应的离子方程式为:S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,故A错误;
B.碳酸钠的水解的离子方程式:CO32-+2H2O?HCO3-+OH-,HCO3-+H20?H2CO3+OH-,故B错误;
C.向Ba(OH)2溶液滴KHSO4溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C错误;
D.Na2HPO4溶于水后发生电离的离子方程式为:Na2HPO4=2Na++HPO42-,故D正确;
故选:D.
B.碳酸钠的水解的离子方程式:CO32-+2H2O?HCO3-+OH-,HCO3-+H20?H2CO3+OH-,故B错误;
C.向Ba(OH)2溶液滴KHSO4溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C错误;
D.Na2HPO4溶于水后发生电离的离子方程式为:Na2HPO4=2Na++HPO42-,故D正确;
故选:D.
点评:本题考查了离子方程式的书写,题目难度不大,把握离子方程式书写的方法是解题关键,注意多元弱酸根离子水解时应分步水解,以第一步为主.

练习册系列答案
相关题目
某混合溶液中所含的离子浓度如下表,则Mn+及a值可能为( )
| 所含离子 | NO3- | SO42- | H+ | Na+ | Mn+ |
| 浓度(mol/L) | 4 | 3.5 | 3 | 5 | a |
| A、Mg2+、2 |
| B、Ba2+、1.5 |
| C、Al3+、0.5 |
| D、K+、3 |
下列离子方程式正确的是( )
| A、Ba(OH)2溶液和H2SO4溶液反应 Ba2++SO42-═BaSO4↓ |
| B、钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
| C、钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na |
| D、Fe和H2SO4反应 2Fe+6H+═2Fe3++3H2↑ |
从下列混合物中分离出其中的一种成分,所采取的分离方法正确的是( )
| A、由于碘在酒精中的溶解度大,可以用酒精把碘水中的碘萃取出来 |
| B、水的沸点为100℃,酒精的沸点为78.5℃,所以用加热蒸馏的方法使含水的酒精变为无水酒精 |
| C、由于沙子和水不相溶,因此可用过滤法分离沙子与水的混合物 |
| D、NaCl的溶解度随温度下降而减小,可以用冷却法从热的含少量的KNO3的NaCl浓溶液中分离得到纯净的NaCl |
 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述不正确的是( )
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述不正确的是( )A、断开K2,闭合K1时,总反应的离子方程式为:2H2O+2Cl-
| ||||
| B、断开K2,闭合K1时,铜电极产生的气体略多于石墨 | ||||
| C、断开K1,闭合K2时,铜电极上的电极反应为:H2-2e-=2 H+ | ||||
| D、断开K1,闭合K2时,溶液中的Na+向石墨电极迁移 |
在给定的四种溶液中,加入以下各种离子后,各离子能在原溶液中大量共存的有( )
| A、滴加酚酞试液显红色的溶液:Fe2+、NH4+、Cl-、I- |
| B、水电离出来的C (H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| C、在C (H+)=10-13mol/L的溶液:K+、SO42-、Al3+、Cl- |
| D、PH=1的溶液:Cu2+、Na+、Mg2+、NO3- |
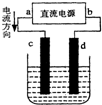 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )| A、a为负极、d为阳极 |
| B、将淀粉KI试纸的玻璃棒靠近d处一段时间会变蓝色 |
| C、电解过程中转移0.2mol电子,d电极质量增加6.4克 |
| D、电解过程中,铜离子向C极移动 |