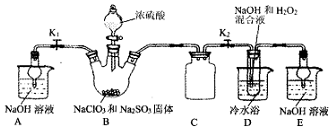
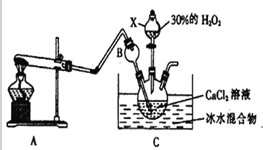
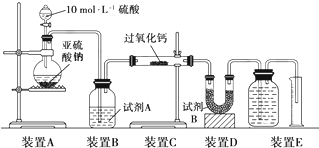
题目内容
15.硼元素在自然界有10B和11B两种同位素,经测定硼的相对原子质量是10.8,求这两种同位素的质量分数.分析 硼有两种天然同位素10B和11B,硼元素的相对原子质量为10.8,先依据十字交叉法计算设10B和11B的物质的之比,再计算硼元素中11B质量分数和10B质量分数,据此解答.
解答 解:硼有两种天然同位素10B和11B,硼元素的相对原子质量为10.8,则运用十字交叉得: ,则10B和11B的物质的量:0.2:0.8=1:4,
,则10B和11B的物质的量:0.2:0.8=1:4,
设10B和11B的物质的量分别是1mol、4mol,
则11B的质量分数=$\frac{11g/mol×4mol}{10g/mol×1mol+11g/mol×4mol}$×100%=81.5%,
10B质量分数=1-81.5%=18.5%,
答:10B和11B两种同位素的质量分数为18.5%、81.5%
点评 本题考查了物质的量的计算,正确理解元素的相对原子质量与核素相对原子质量之间的关系是解本题关键,注意十字交叉法的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列有机坊与其名称相符的是( )
| A. |  :2-甲基丙烯 :2-甲基丙烯 | B. | (CH3)2CHCH(CH3)2:1,4-而甲基丁烷 | ||
| C. | 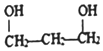 :1,3-二丙醇 :1,3-二丙醇 | D. | 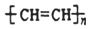 :聚乙烯 :聚乙烯 |
6.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):H2(g)+Cl2(g)-→2HCl(g)+Q1H2(g)+Br2(g)-→2HBr(g)+Q2有关上述反应的叙述正确的是( )
| A. | Q1>Q2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1 mol HCl气体时放出Q1 kJ热量 | |
| D. | 1 mol HBr(g)具有的能量小于1 mol HBr(l)具有的能量 |
10.我国科学家研发出一种新型的锂离子电池,放电时有关离子转化关系如图所示,下列说法正确的是( )
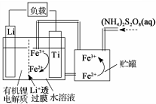

| A. | Li+透过膜除允许Li+通过外,还允许H2O分子通过 | |
| B. | 放电时,进入贮罐的液体发生:S2O82-+2Fe2+=2Fe3++2SO42- | |
| C. | 充电时,钛电极与外电源的负极相连 | |
| D. | 充电时,电池内部发生的总反应为Li++Fe3+=Li+Fe2+ |
20.短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素;Z原子的最外层电子数是其最内层电子数的$\frac{1}{2}$;W的最高正价和最低负价的代数和为0,下列说法正确的是( )
| A. | 原子半径:X<Y<Z<W | |
| B. | Z的氢化物中只含离子键 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应 |
7.分子式为C9H12属于芳香烃的有机物共有(不含立体异构)( )
| A. | 4种 | B. | 7种 | C. | 8种 | D. | 9种 |