题目内容
4.下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
分析 A.①中电解质是弱电解质,在水溶液中电离程度很小;②、③、④中电解质是强电解质,但CO32-水解程度大于HCO3-,HCO3-电离程度较小,HCO3-和铵根离子相互促进水解;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液,溶液中溶质为等物质的量浓度的Na2CO3、NaHCO3,CO32-水解程度大于HCO3-,二者水解导致溶液呈碱性,但水解程度都较小;
D.温下,同浓度的CH3COONa 与CH3COOH 溶液等体积混合,溶液的pH<7,说明CH3COONa的水解程度小于CH3COOH电离程度,根据溶液中电荷守恒判断.
解答 解:A.①中电解质是弱电解质,在水溶液中电离程度很小;②、③、④中电解质是强电解质,但CO32-水解程度大于HCO3-,HCO3-电离程度较小,HCO3-和铵根离子相互促进水解,所以溶液中c(CO32-)的大小关系为:②>④>③>①,故A正确;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故B错误;
C.向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液,溶液中溶质为等物质的量浓度的Na2CO3、NaHCO3,CO32-水解程度大于HCO3-,二者水解导致溶液呈碱性,但水解程度都较小,离子浓度大小顺序是c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.温下,同浓度的CH3COONa 与CH3COOH 溶液等体积混合,溶液的pH<7,说明CH3COONa的水解程度小于CH3COOH电离程度,根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),因为CH3COONa的水解程度小于CH3COOH电离程度,所以c(CH3COOH)+c(OH-)<c(Na+)+c(H+),故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,知道常见盐类水解、弱电解质电离特点,知道电荷守恒和物料守恒的运用,易错选项是D.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案| A. | 标准状况下,22.4 L HF中含HF分子数目为NA | |
| B. | 60 g石英晶体中含有的Si-O键数目为2 NA | |
| C. | 标准状况下,11.2 L Cl2通人足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA | |
| D. | l L 0.1 mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
| A. | 分子式符合XY2型的化合物可能由同一主族元素构成 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 所有的非金属元素都位于元素周期表的右半区 |
| A. | 乙苯和环己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | 糖、油脂、蛋白质都能发生水解反应 | |
| C. | 甲醛和乙二醇都可作为合成高分子化合物的单体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
| A. | 肯定有A13+、Mg2+、NH4+、Cl- | B. | 肯定有Al3+、Mg2+、SO42- | ||
| C. | 肯定没有NH4+、HCO3-、MnO4- | D. | 肯定有Al3+、Mg2+、HCO3- |
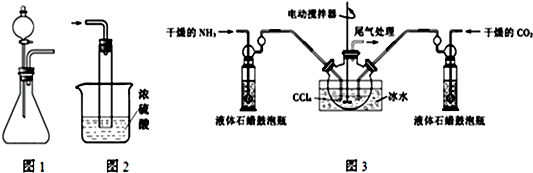



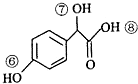 )的说法正确的是AD.
)的说法正确的是AD.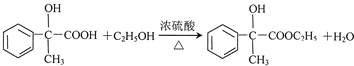 .
.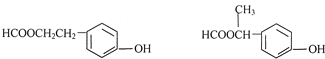 .
.