题目内容
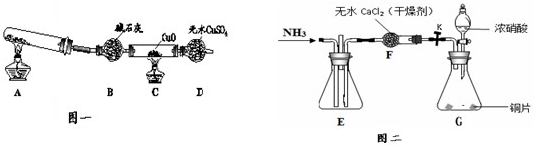
 如图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.
如图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(1)仪器A的名称是
(2)在收集氯气时,应
(3)若要制得标准状况下的Cl20.672L,理论上需要MnO2的物质的量是
(4)实验室也可在不加热的条件下用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O该反应中,氧化剂是
考点:氯气的实验室制法
专题:
分析:(1)熟悉常见仪器,知道其名称;依据氯气在饱和食盐水中溶解度不大的性质解答;氯气有毒,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,用氢氧化钠吸收氯气;
(2)收集氯气时,应关闭b,打开a,用排饱和食盐水法收集;收集完毕,关闭a,打开b,用氢氧化钠溶液吸收多余氯气;
(3)根据氯气的体积求出氯气的物质的量,依据化学方程式从而求出反应的二氧化锰的物质的量;
(4)化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;
根据化学反应转移电子的物质的量结合化学方程式进行计算;
分析方程式中化合价变化,锰元素化合价从+7价变化为+2价,化合价降低,被还原,HCl中的氯元素化合价从-1价变化为0价,化合价升高被氧化得到氧化产物Cl2,.
(2)收集氯气时,应关闭b,打开a,用排饱和食盐水法收集;收集完毕,关闭a,打开b,用氢氧化钠溶液吸收多余氯气;
(3)根据氯气的体积求出氯气的物质的量,依据化学方程式从而求出反应的二氧化锰的物质的量;
(4)化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;
根据化学反应转移电子的物质的量结合化学方程式进行计算;
分析方程式中化合价变化,锰元素化合价从+7价变化为+2价,化合价降低,被还原,HCl中的氯元素化合价从-1价变化为0价,化合价升高被氧化得到氧化产物Cl2,.
解答:
解:(1)根据仪器特点可知A为分液漏斗;食盐水中含有氯离子能抑制氯气的溶解,实验室常用排饱和食盐水法收集氯气;氢氧化钠和氯气反应生成氯化钠、次氯酸钠和水,方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:分液漏斗;饱和食盐水;Cl2+2NaOH=NaCl+NaClO+H2O;
(2)氯气在饱和氯化钠溶液中的溶解度很小,实验室常用排饱和食盐水法收集氯气,收集时,应关闭b,打开a;收集完毕,关闭a,打开b,多余的气体通入氢氧化钠溶液进行吸收,防止污染空气,
故答案为:关闭b,打开a;关闭a,打开b;
(3)n(Cl2)=
=
=0.03mol;
生成0.03molCl2反应的二氧化锰物质的量为x;
MnO2+4HCl
MnCl2+Cl2↑+2H2O
1 1
x 0.03mol
x=0.03mol,所以理论上反应的二氧化锰质量0.03mol;
故答案为:0.03mol;
(4)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素所在的HCl反应物是还原剂,氯气是氧化产物,化合价降低的Mn元素所在的反应物KMnO4是氧化剂,反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,参加反应的16mol盐酸中,只有10mol盐酸被氧化,转移电子为10mol,生成5mol氯气,当有1mol电子发生转移时,则有1molHCl被氧化,生成0.5mol氯气,体积V=0.5mol×22.4L/mol=11.2L;
依据化合价变化,锰元素化合价从+7价变化为+2价,化合价降低,被还原,HCl中的氯元素化合价从-1价变化为0价,化合价升高被氧化得到氧化产物Cl2,用双线桥表示为:
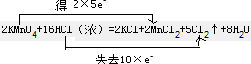 ;
;
故答案为:高锰酸钾,氯气;11.2; .
.
故答案为:分液漏斗;饱和食盐水;Cl2+2NaOH=NaCl+NaClO+H2O;
(2)氯气在饱和氯化钠溶液中的溶解度很小,实验室常用排饱和食盐水法收集氯气,收集时,应关闭b,打开a;收集完毕,关闭a,打开b,多余的气体通入氢氧化钠溶液进行吸收,防止污染空气,
故答案为:关闭b,打开a;关闭a,打开b;
(3)n(Cl2)=
| V |
| Vm |
| 0.672L |
| 22.4L/mol |
生成0.03molCl2反应的二氧化锰物质的量为x;
MnO2+4HCl
| ||
1 1
x 0.03mol
x=0.03mol,所以理论上反应的二氧化锰质量0.03mol;
故答案为:0.03mol;
(4)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素所在的HCl反应物是还原剂,氯气是氧化产物,化合价降低的Mn元素所在的反应物KMnO4是氧化剂,反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,参加反应的16mol盐酸中,只有10mol盐酸被氧化,转移电子为10mol,生成5mol氯气,当有1mol电子发生转移时,则有1molHCl被氧化,生成0.5mol氯气,体积V=0.5mol×22.4L/mol=11.2L;
依据化合价变化,锰元素化合价从+7价变化为+2价,化合价降低,被还原,HCl中的氯元素化合价从-1价变化为0价,化合价升高被氧化得到氧化产物Cl2,用双线桥表示为:
 ;
;故答案为:高锰酸钾,氯气;11.2;
 .
.
点评:本题考查氯气的性质与实验室制备,氧化还原反应的相关计算,掌握氯气实验室制备的原理与注意事项,准确分析氧化还原反应是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质按括号里的类别进行分类都正确的是( )
| A、空气(混合物)、C2H5OH(有机物)、H2SO4(化合物)、CO2(电解质) |
| B、液氨(非电解质)、NH4Cl(盐)、HNO3(含氧酸)、NaOH(强电解质) |
| C、HCl(化合物)、NaHCO3(酸)、Na2O2(碱性氧化物)、CCl4(电解质) |
| D、SO2(酸性氧化物)、CuSO4?5H2O(混合物)、CaO(碱性氧化物)BaCO3(电解质) |
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A、氢氧化钠与盐酸;氢氧化钠与醋酸 |
| B、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
| C、Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 |
| D、石灰石与硝酸;碳酸钙与盐酸 |
已知25℃时溶解度:AgCl>AgI,若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
| A、c (K+)>c (NO3-)>c (Ag+)=c (Cl-)+c (I-) |
| B、c (K+)>c (NO3-)>c (Ag+)>c (Cl-)>c (I-) |
| C、c (NO3-)>c (K+)>c (Ag+)>c (Cl-)>c (I-) |
| D、c (K+)>c (NO3-)>c (Cl-)>c (Ag+)>c (I-) |
常温下,有关下列四种溶液的叙述正确的是(忽略混合后溶液的体积变化)( )
| ① | ② | ③ | ④ | |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | NaOH | CH3COOH | HCl |
| A、在①、②中分别加入氯化铵固体,两溶液的 pH均增大 |
| B、分别将等体积的①和②加水稀释m倍和n倍后,pH仍相同,则:m>n |
| C、把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、将溶液②和溶液③等体积混合,混合后所得溶液的pH=7 |
下列说法正确的是( )
| A、pH=6的溶液一定呈酸性 |
| B、25℃时,pH=7的一定是纯水 |
| C、溶于水呈中性的盐一定未发生水解 |
| D、酸碱恰好中和时,溶液不一定为中性 |
下列说法中不正确的是( )
| A、1 mol 氧气中含有6.02×1023个氧原子,在标准状况下占有体积22.4 L |
| B、1 mol臭氧和1.5 mol氧气含有相同的氧原子数 |
| C、等体积、浓度均为1 mol/L的硫酸和盐酸,电离出的氢离子数之比为2:1 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |