题目内容
A是一种强酸,其浓度超过40%时就会迅速分解,产生比它的酸性更强的酸B,同时放出气体C和D,该气体经干燥后,平均分子量为47.6,所得气体通过80℃NaOH溶液,得到的产物中一种是A的钠盐,同时还剩余一种可以使带火星的木条复燃的气体D.试完成下列各题:
(1)确定各物质的化学式A 、B 、C 、D ;
(2)气体C和D的体积比 ;
(3)写出A分解方程式并配平; ;
(4)写出气体C与湿润的淀粉-碘化钾试纸的反应方程式 ;
(5)写出将气体C通过80℃NaOH溶液时发生的反应方程式 .
(1)确定各物质的化学式A
(2)气体C和D的体积比
(3)写出A分解方程式并配平;
(4)写出气体C与湿润的淀粉-碘化钾试纸的反应方程式
(5)写出将气体C通过80℃NaOH溶液时发生的反应方程式
考点:无机物的推断
专题:
分析:A是一种强酸,其浓度超过40%时就会迅速分解,产生比它的酸性更强的酸B,同时放出气体C和D,该气体经干燥后,平均分子量为47.6,所得气体通过80℃NaOH溶液,得到的产物中一种是A的钠盐,同时还剩余一种可以使带火星的木条复燃的气体D为O2
(1)氯酸分解产生比它的酸性更强的含氧酸是高氯酸(HClO4),生成的可以使带火星的木条复燃的气体是O2,生成的可以使湿润的淀粉碘化钾试纸变蓝后褪色的气体是Cl2.生成的氧气和氯气的平均相对分子质量为47.6,由此可以计算生成的氧气和氯气的物质的量之比;
(2)设氧气和氯气组成的混合气体中,氧气的物质的量分数为x,氯气的物质的量分数为(1-x),则:32x+71(1-x)=47.6,解得:x:(1-x)=3:2,即氧气和氯气的物质的量之比为3:2;
(3)根据氧化还原反应过程中得失电子守恒可以确定HClO4的化学计量数.由解析(1)及题意可知,氯酸分解的化学方程式为:(a+4)HClO3=aHClO4+3O2↑+2Cl2↑+2H2O,根据得失电子守恒有:a×2+2×2×3=5×2×2,得a=4.因此配平的化学方程式为:8HClO3=4HClO4+3O2↑+2Cl2↑+2H2O;
(4)该气体混合物与湿润的淀粉碘化钾试纸作用的化学方程式分别为:Cl2+2KI=2KCl+I2,5Cl2+I2+6H2O=2HIO3+10HCl;
(5)将该气体混合物通过80℃NaOH溶液,这时Cl2与热的烧碱溶液发生反应:3Cl2+6NaOH
5NaCl+NaClO3+3H2O;
(1)氯酸分解产生比它的酸性更强的含氧酸是高氯酸(HClO4),生成的可以使带火星的木条复燃的气体是O2,生成的可以使湿润的淀粉碘化钾试纸变蓝后褪色的气体是Cl2.生成的氧气和氯气的平均相对分子质量为47.6,由此可以计算生成的氧气和氯气的物质的量之比;
(2)设氧气和氯气组成的混合气体中,氧气的物质的量分数为x,氯气的物质的量分数为(1-x),则:32x+71(1-x)=47.6,解得:x:(1-x)=3:2,即氧气和氯气的物质的量之比为3:2;
(3)根据氧化还原反应过程中得失电子守恒可以确定HClO4的化学计量数.由解析(1)及题意可知,氯酸分解的化学方程式为:(a+4)HClO3=aHClO4+3O2↑+2Cl2↑+2H2O,根据得失电子守恒有:a×2+2×2×3=5×2×2,得a=4.因此配平的化学方程式为:8HClO3=4HClO4+3O2↑+2Cl2↑+2H2O;
(4)该气体混合物与湿润的淀粉碘化钾试纸作用的化学方程式分别为:Cl2+2KI=2KCl+I2,5Cl2+I2+6H2O=2HIO3+10HCl;
(5)将该气体混合物通过80℃NaOH溶液,这时Cl2与热的烧碱溶液发生反应:3Cl2+6NaOH
| ||
解答:
解:(1)氯酸分解产生比它的酸性更强的含氧酸是高氯酸(HClO4),生成的可以使带火星的木条复燃的气体是O2,生成的可以使湿润的淀粉碘化钾试纸变蓝后褪色的气体是Cl2;判断A为HClO3,B为HClO4,C为Cl2,D为O2;
故答案为:HClO3,HClO4,Cl2,O2;
(2)生成的氧气和氯气的平均相对分子质量为47.6,设氧气和氯气组成的混合气体中,氧气的物质的量分数为x,氯气的物质的量分数为(1-x),则:32x+71(1-x)=47.6,解得:x:(1-x)=3:2,即氧气和氯气的物质的量之比为3:2;
故答案为:3:2;
(3)根据氧化还原反应过程中得失电子守恒可以确定HClO4的化学计量数.由解析(1)及题意可知,氯酸分解的化学方程式为:(a+4)HClO3=aHClO4+3O2↑+2Cl2↑+2H2O,根据得失电子守恒有:a×2+2×2×3=5×2×2,得a=4.因此配平的化学方程式为:8HClO3=4HClO4+3O2↑+2Cl2↑+2H2O;
故答案为:8HClO3=4HClO4+3O2↑+2Cl2↑+2H2O;
(4)该气体混合物与湿润的淀粉碘化钾试纸作用,C与湿润的淀粉-碘化钾试纸的反应的化学方程式分别为:Cl2+2KI=2KCl+I2;
故答案为:Cl2+2KI=2KCl+I2;
(5)将该气体混合物通过80℃NaOH溶液,这时Cl2与热的烧碱溶液发生反应:3Cl2+6NaOH
5NaCl+NaClO3+3H2O;
故答案为:3Cl2+6NaOH
5NaCl+NaClO3+3H2O.
故答案为:HClO3,HClO4,Cl2,O2;
(2)生成的氧气和氯气的平均相对分子质量为47.6,设氧气和氯气组成的混合气体中,氧气的物质的量分数为x,氯气的物质的量分数为(1-x),则:32x+71(1-x)=47.6,解得:x:(1-x)=3:2,即氧气和氯气的物质的量之比为3:2;
故答案为:3:2;
(3)根据氧化还原反应过程中得失电子守恒可以确定HClO4的化学计量数.由解析(1)及题意可知,氯酸分解的化学方程式为:(a+4)HClO3=aHClO4+3O2↑+2Cl2↑+2H2O,根据得失电子守恒有:a×2+2×2×3=5×2×2,得a=4.因此配平的化学方程式为:8HClO3=4HClO4+3O2↑+2Cl2↑+2H2O;
故答案为:8HClO3=4HClO4+3O2↑+2Cl2↑+2H2O;
(4)该气体混合物与湿润的淀粉碘化钾试纸作用,C与湿润的淀粉-碘化钾试纸的反应的化学方程式分别为:Cl2+2KI=2KCl+I2;
故答案为:Cl2+2KI=2KCl+I2;
(5)将该气体混合物通过80℃NaOH溶液,这时Cl2与热的烧碱溶液发生反应:3Cl2+6NaOH
| ||
故答案为:3Cl2+6NaOH
| ||
点评:本题考查了特征物质性质的分析判断,反应现象和产物的理解应用,电子守恒计算分析,离子方程式书写方法,掌握基础是解题关键,题目难度较大.

练习册系列答案
相关题目
下列物质的分离方法不正确的是( )
| A、用过滤的方法除去食盐水中的泥沙 |
| B、用分液法分离酒精和水 |
| C、用四氯化碳萃取碘水中的碘 |
| D、用蒸馏的方法将自来水制成蒸馏水 |
向溶液X中持续通入气体Y,不会产生“浑浊-→澄清”现象的是( )
| A、X:漂白粉溶液Y:二氧化硫 |
| B、X:硝酸银溶液Y:氨气 |
| C、X:氢氧化钡溶液Y:二氧化碳 |
| D、X:偏铝酸钠溶液Y:二氧化氮 |
甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL0.1mol?L-1 AlCl3溶液,两烧杯中都有沉淀生成.下列判断正确的是( )
| A、甲中沉淀一定比乙中的多 |
| B、甲中沉淀可能比乙中的少 |
| C、甲中沉淀一定比乙中的少 |
| D、甲中和乙中的沉淀可能一样多 |
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
| A、3.6mol/L |
| B、3.2mol/L |
| C、2.8mol/L |
| D、2.4mol/L |
3L Al2(SO4)3 溶液中含Al3+ag,则这种Al2(SO4)3 溶液的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
 ,物质A在体内脱氢酶的作用下会氧化为有害物质GHB.下图是关于物质A的一种制备方法及由A引发的一系列化学反应.
,物质A在体内脱氢酶的作用下会氧化为有害物质GHB.下图是关于物质A的一种制备方法及由A引发的一系列化学反应.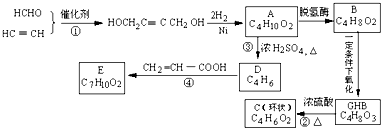
 结构),它的结构简式为
结构),它的结构简式为 如图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.
如图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.