题目内容
为探究氨气的还原性,某活动小组同学设计了两种实验装置(K为止水夹,夹持固定装置略去).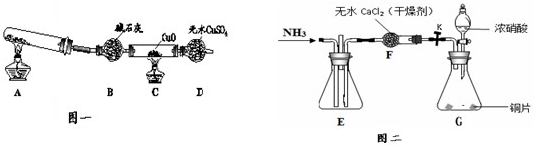
任务一:活动小组利用如图一所示装置进行CuO和NH3的实验探究活动.
(1)实验室制取氨气的化学方程式为 .
(2)实验中同学观察到:C装置玻璃管中有红色物质生成,D处无水CuSO4变为蓝色,同时生成一种无污染的气体.请写出氨气与CuO反应的化学方程式 .
(3)有同学认为:C装置玻璃管中红色物质可能含有Cu2O(已知:Cu2O在酸性溶液中不稳定,Cu+→Cu+Cu2+).当CuO完全反应后,如何检验该红色物质中是否含有Cu2O .
任务二:小组利用如图二所示装置探究NO2能否被NH3还原.
(4)G装置中制取NO2反应的离子化学方程式是 .
(5)若NO2能够被NH3还原,预期观察到E装置中的现象是 .
(6)以上两套装置是否存在缺陷,其缺陷是 .

任务一:活动小组利用如图一所示装置进行CuO和NH3的实验探究活动.
(1)实验室制取氨气的化学方程式为
(2)实验中同学观察到:C装置玻璃管中有红色物质生成,D处无水CuSO4变为蓝色,同时生成一种无污染的气体.请写出氨气与CuO反应的化学方程式
(3)有同学认为:C装置玻璃管中红色物质可能含有Cu2O(已知:Cu2O在酸性溶液中不稳定,Cu+→Cu+Cu2+).当CuO完全反应后,如何检验该红色物质中是否含有Cu2O
任务二:小组利用如图二所示装置探究NO2能否被NH3还原.
(4)G装置中制取NO2反应的离子化学方程式是
(5)若NO2能够被NH3还原,预期观察到E装置中的现象是
(6)以上两套装置是否存在缺陷,其缺陷是
考点:性质实验方案的设计,氨的化学性质
专题:实验设计题
分析:(1)实验室用固体氯化铵和熟石灰粉末混合加热制取氨气的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)由题意可知生成物为铜、氮气和水,以此书写化学方程式;
(3)若红色物质只有铜,不溶于稀硫酸,若红色物质含有Cu2O,因为Cu2O在酸性溶液中不稳定,Cu+→Cu+Cu2+,所以溶液会显蓝色;
(4)铜和浓硝酸反应生成硝酸铜,二氧化氮和水,依据反应写出离子方程式;
(5)若NO2能够被NH3还原,则混合气体的颜色将变浅;
(6)有毒气体不能直接排空,需用尾气吸收装置.
| ||
(2)由题意可知生成物为铜、氮气和水,以此书写化学方程式;
(3)若红色物质只有铜,不溶于稀硫酸,若红色物质含有Cu2O,因为Cu2O在酸性溶液中不稳定,Cu+→Cu+Cu2+,所以溶液会显蓝色;
(4)铜和浓硝酸反应生成硝酸铜,二氧化氮和水,依据反应写出离子方程式;
(5)若NO2能够被NH3还原,则混合气体的颜色将变浅;
(6)有毒气体不能直接排空,需用尾气吸收装置.
解答:
解:(1)实验室用氯化铵和消石灰反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)根据氨气和氧化铜反应的现象:CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明生成铜、氮气和水,反应的化学方程式为3CuO+2NH3
3Cu+N2+3H2O,故答案为:3CuO+2NH3
3Cu+N2+3H2O;
(3)铜的活泼性排在氢的后面,所以如果红色物质只有铜,加硫酸不溶解,溶液颜色,不变;如果含有Cu2O,因为Cu2O在酸性溶液中不稳定,Cu+→Cu+Cu2+,所以溶液加硫酸后溶液显蓝色,
故答案为:取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有;
(4)铜和浓硝酸反应生成硝酸铜,二氧化氮和水,反应写出离子方程式为;Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(5)二氧化氮是红棕色气体,如果能被氨气还原,生成无色气体氮气,则E装置中混合气体颜色变浅,
故答案为:E装置中混合气体颜色变浅;
(6)二氧化氮是有毒气体,氨气是有刺激性气味的气体,所以都不能直接排空,要进行尾气处理才能排空,
故答案为:缺少尾气吸收.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)根据氨气和氧化铜反应的现象:CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明生成铜、氮气和水,反应的化学方程式为3CuO+2NH3
| ||
| ||
(3)铜的活泼性排在氢的后面,所以如果红色物质只有铜,加硫酸不溶解,溶液颜色,不变;如果含有Cu2O,因为Cu2O在酸性溶液中不稳定,Cu+→Cu+Cu2+,所以溶液加硫酸后溶液显蓝色,
故答案为:取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有;
(4)铜和浓硝酸反应生成硝酸铜,二氧化氮和水,反应写出离子方程式为;Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(5)二氧化氮是红棕色气体,如果能被氨气还原,生成无色气体氮气,则E装置中混合气体颜色变浅,
故答案为:E装置中混合气体颜色变浅;
(6)二氧化氮是有毒气体,氨气是有刺激性气味的气体,所以都不能直接排空,要进行尾气处理才能排空,
故答案为:缺少尾气吸收.
点评:本题是实验探究题,考查了氨气的实验室制法和性质,二氧化氮性质的实验,更侧重考查学生分析、设计实验的能力,解题时注意语言叙述的规范性、完整性.

练习册系列答案
相关题目
X2气和Y2气共100mL,一定条件下使它们充分反应,恢复到原状况时,发现体积仍是100mL,这说明( )
| A、X2气过量 |
| B、X2气Y2气各50mL |
| C、产物是双原子分子 |
| D、无法作出上述判断 |
下列物质的分离方法不正确的是( )
| A、用过滤的方法除去食盐水中的泥沙 |
| B、用分液法分离酒精和水 |
| C、用四氯化碳萃取碘水中的碘 |
| D、用蒸馏的方法将自来水制成蒸馏水 |
黑火药爆炸反应为:S+2KNO3+3C=K2S+3CO2↑+N2↑,在该反应中,氧化剂是( )
①C ②S ③K2S ④KNO3 ⑤N2.
①C ②S ③K2S ④KNO3 ⑤N2.
| A、①③⑤ | B、②④ |
| C、②④⑤ | D、③④⑤ |
向溶液X中持续通入气体Y,不会产生“浑浊-→澄清”现象的是( )
| A、X:漂白粉溶液Y:二氧化硫 |
| B、X:硝酸银溶液Y:氨气 |
| C、X:氢氧化钡溶液Y:二氧化碳 |
| D、X:偏铝酸钠溶液Y:二氧化氮 |
 ,物质A在体内脱氢酶的作用下会氧化为有害物质GHB.下图是关于物质A的一种制备方法及由A引发的一系列化学反应.
,物质A在体内脱氢酶的作用下会氧化为有害物质GHB.下图是关于物质A的一种制备方法及由A引发的一系列化学反应.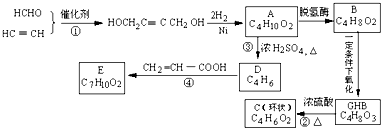
 结构),它的结构简式为
结构),它的结构简式为 如图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.
如图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.