题目内容
17.能正确表示下列反应的离子方程式的是( )| A. | NH4Fe(SO4)2加入过量NaOH溶液中::NH4++Fe3++4OH-═NH3•H2O+Fe(OH)3↓ | |
| B. | 次氯酸钠溶液中通入过量的二氧化硫:ClO-+SO2+H2O═HSO3-+HClO | |
| C. | Ba(OH)2溶液和稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
分析 A.铵根离子、铁离子与氢氧根离子反应生成一水合氨、氢氧化铁沉淀;
B.次氯酸具有强氧化性,能够将亚硫酸氢根离子氧化成硫酸根离子;
C.氢离子、氢氧根离子的系数错误,与硫酸、氢氧化钡的化学式组成不相符;
D.碳酸氢钠足量,离子方程式按照氢氧化钙的化学式组成书写.
解答 解:A.NH4Fe(SO4)2加入过量NaOH溶液中,反应的离子方程式为:NH4++Fe3++4OH-═NH3•H2O+Fe(OH)3↓,故A正确;
B.次氯酸钠溶液中通入过量的二氧化硫,反应生成硫酸根离子、氢离子和氯离子,正确的离子方程式为:ClO-+SO2+H2O═SO42-+2H++Cl-,故B错误;
C.Ba(OH)2溶液和稀硫酸反应生成硫酸钡沉淀和水,反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C错误;
D.澄清石灰水中加入过量的NaHCO3溶液,反应生成碳酸钙沉淀、碳酸钠和水,正确的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)M的离子结构示意图为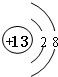 ;元素T周期表中位于第ⅦA族.
;元素T周期表中位于第ⅦA族.
(2)J和氢组成的化合物分子有4个原子,其结构式为H-C≡C-H.
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为AlCl3+3H2O=Al(OH)3+3HCl↑.
(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2+8H2O.
②由甲与氧气、KOH 溶液构成原电池,负极会产生L的单质.则其负极反应式为2NH3-6e-+6OH-═N2+6H2O.
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol.
| J | ||||
| R |
 ;元素T周期表中位于第ⅦA族.
;元素T周期表中位于第ⅦA族.(2)J和氢组成的化合物分子有4个原子,其结构式为H-C≡C-H.
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为AlCl3+3H2O=Al(OH)3+3HCl↑.
(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2+8H2O.
②由甲与氧气、KOH 溶液构成原电池,负极会产生L的单质.则其负极反应式为2NH3-6e-+6OH-═N2+6H2O.
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol.
5.下列关于能源的说法不正确的是( )
| A. | 氢能源的优点是来源广泛、无污染、便于运输与贮存 | |
| B. | 自然界中利用太阳能最成功的是植物的光合作用 | |
| C. | 植物秸秆、动物粪便、枯枝败叶中蕴藏着丰富的生物质能 | |
| D. | 利用太阳能、风能和氢能替代化石能源能改善空气质量 |
12.向amolNaOH的溶液中通入bmolCO2,下列说法不正确的是( )
| A. | 当a≥2b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a≤b时,发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:3OH-+2CO2═CO32-+HCO3-+H2O | |
| D. | 当$\frac{a}{2}$<b<a时,溶液中HCO3-与CO32-的物质的量之比为(a-b):(2b-a) |
2.下列分子晶体中,关于熔沸点高低的比较,正确的是( )
| A. | Cl2>I2 | B. | SiCl4>CCl4 | ||
| C. | NH3>PH3 | D. | C(CH3)4>CH3CH2CH2CH2CH3 |
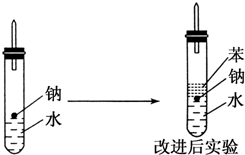 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.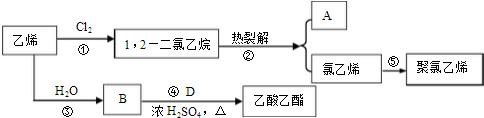
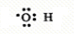 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基. (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.