题目内容
5.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸.反应原理:
已知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;
苯甲酸的熔点为122.4℃,在25℃和95℃下在水中溶解度分别为0.344g和6.8g.
Ⅰ.【制备产品】将30.0mL甲苯和25.0mL 1mol/L高锰酸钾溶液在100℃下反应30min,装置如图1所示.

(1)仪器A的名称为冷凝管,A的进水口为a(填“a”或“b”).支管的作用是平衡压强,使甲苯顺利滴入三颈烧瓶.
(2)在本实验中,三颈烧瓶最合适的容积是B(填字母).
A.50mL B.100mL C.250mL D.500mL
Ⅱ.【分离产品】该同学设计如图2流程分离粗产品苯甲酸和回收甲苯.

(3)操作Ⅰ的名称是分液;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是蒸馏.
Ⅲ.【纯度测定】称取1.220g白色固体,配成100mL甲醇溶液,取25.00mL溶液,用0.1000mol/LKOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(5)从白色固体B中得到纯净的苯甲酸的实验方法是:重结晶.
分析 (1)根据仪器构造A为冷凝管;逆流的冷却的效率高,下方为进水口;支管连接了恒压滴液漏斗中的液体上、下方,使恒压滴液漏斗中的液体上、下方的压强相等,便于甲苯顺利滴入三颈烧瓶;
(2)30.0mL甲苯和25.0mL 1mol/L高锰酸钾溶液,总共55mL液体,据此选择三颈烧瓶的规格;
(3)依据流程经过操作Ⅰ得到有机相和水相,说明为分液,通过物质沸点差异从有机相中获得甲苯的方法为蒸馏;
(4)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则读取的溶液的体积小于实际用掉的溶液的体积,据此判断;根据苯甲酸纯度=$\frac{苯甲酸的质量}{样品的质量}$×100%计算纯度;
(5)苯甲酸的溶解度随温度的升高而增大,选择重结晶得到纯净的苯甲酸.
解答 解:(1)根据仪器构造仪器A为冷凝管,由逆流的冷却的效率高的原理可知,进水口应在冷凝管的下方a处,支管连接了恒压滴液漏斗中的液体上、下方,使恒压滴液漏斗中的液体上、下方的压强相等,便于甲苯顺利滴入三颈烧瓶;
故答案为:冷凝管;a;平衡压强,使甲苯顺利滴入三颈烧瓶;
(2)本实验中用到的液体30.0mL甲苯和25.0mL 1mol/L高锰酸钾溶液,体积约为55mL,所以选择100mL的三颈烧瓶;
故答案为:B;
(3)由流程知操作Ⅰ是有机相甲苯与水相分离,用分液方法得到;操作Ⅱ是蒸馏的方法控制甲苯沸点得到纯净的甲苯液体;
故答案为:分液;蒸馏;
(4)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则读取的溶液的体积小于实际用掉的溶液的体积,所以测定结果偏小;第三次实验数据相差太大,舍去,则消耗氢氧化钾的体积为$\frac{24.00+24.10+23.90}{3}$mL=24.00mL,苯甲酸是一元弱酸和氢氧化钾1:1反应,所以物质的量相同,苯甲酸纯度=$\frac{2.4×1{0}^{-3}mol×4×122/mol}{1.22g}$×100%=96%;
故答案为:偏小;96%;
(5)苯甲酸的溶解度随温度的升高而增大,选择重结晶得到纯净的苯甲酸;
故答案为:重结晶.
点评 本题考查了物质制备的实验分析判断,涉及仪器,物质分离条件,试剂选择,样品纯度的计算,注意答题时从题中获取有用的信息,题目难度中等.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案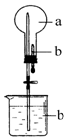 在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )
在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )| A. | NO2和H2O | B. | SO2和NaOH溶液 | ||
| C. | NH3和H2O | D. | H2、O2混合气体与饱和食盐水 |
| A. | 氨水 | B. | HCl | C. | NaOH | D. | 石蕊试液 |
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:丙<丁<戊 | |
| B. | 金属性:甲>乙 | |
| C. | 最外层电子数:甲>乙 | |
| D. | 最高价氧化物的水化物的碱性:丙>丁>戊 |
| A. | CO2+2OH-═CO32-+H2O | B. | Al2O3+2OH-+═2 AlO2-+H2O | ||
| C. | Al3++4OH-═AlO2-+2H2O | D. | 2 Al+2OH-+6H2O═2 AlO2-++3 H2↑ |
| A. | 都是白色的固体 | B. | 都能和水反应形成强碱溶液 | ||
| C. | 都是碱性氧化物 | D. | 焰色反应的颜色都是紫色 |

 实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答:
实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答: