题目内容
16.将含有O2和CH4的混合气体置于盛有23.4g Na2O2的密闭容器中,电火花点燃,反应结束,容器内的压强为零(温度150℃),将残留物溶于水,无气体产生,下列叙述正确的是( )| A. | 原混合气体中O2和CH4的体积比为2:1 | |
| B. | 残留物中只有Na2CO3 | |
| C. | 原混合气体中O2和CH4的物质的量之比为1:2 | |
| D. | 残留物只有Na2CO3和NaOH |
分析 将含有O2和CH4的混合气体置于盛有23.4g Na2O2的密闭容器中,电火花点燃反应为,CH4+2O2=CO2+2H2O;
2CO2+2Na2O2=2Na2CO3+O2;2H2O+2Na2O2=4NaOH+O2;根据题意可知反应结束后,容器内的压强为零(150℃),说明无气体剩余,则甲烷、氧气、过氧化钠全部反应,将残留物溶于水中,无气体产生说明无过氧化钠剩余,则23.4g Na2O2全部反应,物质的量为0.3mol;根据上述三个反应得到:2CH4+O2+6Na2O2=2Na2CO3+8NaOH;
解答 解:A、根据上述分析得到的反应可知,O2和CH4按照1:2恰好与0.3mol过氧化钠反应,无气体剩余,原混合气体中O2和CH4的体积比为2:1时,剩余甲烷,故A错误;
B、甲烷燃烧生成的气体有二氧化碳和水蒸气,所以和过氧化钠反应时残留物有Na2CO3和NaOH,故B错误;
C、根据上述分析得到的反应可知,O2和CH4按照1:2恰好与0.3mol过氧化钠反应,故C正确;
D、由题意结合分析得到的反应关系可知,残留物只有Na2CO3和NaOH,故D正确;
故选CD.
点评 本题考查了甲烷的性质、过氧化钠的性质、气体吸收后的产物判断和计算.

练习册系列答案
相关题目
1.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述正确的是( )
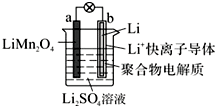

| A. | 充电时,a为阴极 | |
| B. | 充电时,溶液中Li+从b向a迁移 | |
| C. | 电池放电时负极反应为Li-e-═Li+ | |
| D. | 利用该电池电解水,消耗锂14 g可生成气体33.6 L |
4.已知丁基有4种结构,则分子式为C5H10O2且能与NaHCO3发生反应的羧酸有( )种.
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
11.相对分子质量为120的芳香烃有两个取代基,在铁粉作用下与Cl2反应,生成的一氯代物有( )
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
8.在Al、Si、P、S四种元素中,第一电离能最大的是( )
| A. | Al | B. | Si | C. | P | D. | S |
5.下列有关概念说法正确的是( )
| A. | D2、T2、H2互为同素异形体 | B. | 石墨、金刚石互为同位素 | ||
| C. | 甲烷和异丁烷互为同系物 | D. | 乙烷和乙烯互为同分异构体 |
6.某化学研究性学习小组对铜及铜的部分化合物的性质进行实验探究,研究的问题和过程如下:
Ⅰ.氯化铜的制备
该研究性小组在实验室里用如表仪器和药品来制取纯净的无水氯化铜:
图中A、B、C、D、E、F的虚线部分表示玻璃管接口,接口的弯曲和伸长等部分未画出.根据要求填写下列各小题空白.
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号,用①、②等序号填写):③接⑤接④接②接①接⑥.
(2)装置④的作用是除去氯气中混杂的氯化氢气体;
(3)在装置⑤的烧瓶中,发生反应的化学方程式为4NaCl+4H2SO4(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+4NaHSO4+Cl2↑+2H2O
Ⅱ.探究Cu(OH)2是否和Al(OH)3一样具有两性
(4)该研究性学习小组取适量实验Ⅰ中制得的产品氯化铜固体充分溶解在一定浓度的盐酸中,过滤,得氯化铜溶液;为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择配制的氯化铜溶液外,还需要一定选用的试剂为bc (填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
Ⅲ.探究不同价态铜的稳定性
(5)该研究性学习小组用实验Ⅱ中所获得的氢氧化铜沉淀制得氧化铜粉末,然后将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更稳定 (填“稳定”或“不稳定”).
(6)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为Cu2O+2H+=H2O+Cu2++Cu.
Ⅰ.氯化铜的制备
该研究性小组在实验室里用如表仪器和药品来制取纯净的无水氯化铜:
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 | 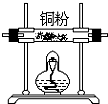 | 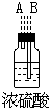 | 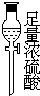 | 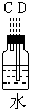 | 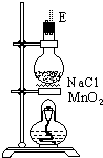 | 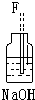 |
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号,用①、②等序号填写):③接⑤接④接②接①接⑥.
(2)装置④的作用是除去氯气中混杂的氯化氢气体;
(3)在装置⑤的烧瓶中,发生反应的化学方程式为4NaCl+4H2SO4(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+4NaHSO4+Cl2↑+2H2O
Ⅱ.探究Cu(OH)2是否和Al(OH)3一样具有两性
(4)该研究性学习小组取适量实验Ⅰ中制得的产品氯化铜固体充分溶解在一定浓度的盐酸中,过滤,得氯化铜溶液;为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择配制的氯化铜溶液外,还需要一定选用的试剂为bc (填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
Ⅲ.探究不同价态铜的稳定性
(5)该研究性学习小组用实验Ⅱ中所获得的氢氧化铜沉淀制得氧化铜粉末,然后将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更稳定 (填“稳定”或“不稳定”).
(6)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为Cu2O+2H+=H2O+Cu2++Cu.