题目内容
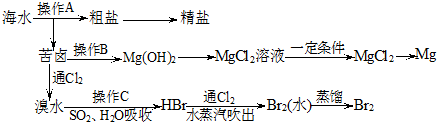
2.ClO2和Cl2都是常用的自来水消毒剂,但我国从2000年起逐步用ClO2代替Cl2对饮用水进行消毒.(1)工业上制取Cl2的化学反应方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)自来水厂用ClO2处理后的自来水的pH为5.5~6.5,要求其中ClO2的浓度在0.1~0.8mg•L-1之间.某研究牲学习小组.为了检测某自来水样中ClO2的浓度是否超标,进行了如下实验:
I.准确量取10.00mL自来水样,稀释成100.00mL试样备用;
Ⅱ.量取20.00mL试样加入锥形瓶中;滴加NaOH溶液调至中性,再加入稍过量的KI晶体,静置片刻;(己知:中性条件下,2ClO2+2I-=2ClO2-+I2)
Ⅲ.加入指示剂X,用2.0×10-5mol•L-1的Na2S2O3溶液至终点,消耗Na2S2O3溶液10.00mL.(已知:2S2O32-+I2=S4O62-+2I- ).
请回答:
①指示剂X是:淀粉
②滴定终点的颜色变化为由蓝色变为无色.
③试计算此水样中ClO2的浓度(单位:mg•L-1)并判断ClO2的浓度是否超标.
分析 (1)工业用电解饱和食盐水制备氯气;
(2)滴加NaOH溶液调至中性,再加入稍过量的KI晶体发生2ClO2+2I-=2ClO2-+I2,加入Na2S2O3溶液发生2S2O32-+I2=S4O62-+2I-,可用淀粉为指示剂,反应终点溶液由蓝色变为无色,结合反应的关系式计算.
解答 解:(1)工业用电解饱和食盐水制备氯气,反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)①操作Ⅱ生成碘,加入淀粉变蓝色,碘与Na2S2O3溶液发生2S2O32-+I2=S4O62-+2I-,可用淀粉为指示剂,故答案为:淀粉;
②加入淀粉变蓝色,随着碘的消耗,溶液变为无色,故答案为:由蓝色变为无色;
③滴加NaOH溶液调至中性,再加入稍过量的KI晶体发生2ClO2+2I-=2ClO2-+I2,加入Na2S2O3溶液发生2S2O32-+I2=S4O62-+2I-,反应的关系式为2ClO2~I2~2S2O32-,
n(Na2S2O3)=2.0×10-5mol•L-1×0.01L=2.0×10-7mol,则n(ClO2)=2.0×10-7mol,
此水样中ClO2的浓度为$\frac{2.0×1{0}^{-7}mol×67.5g/mol}{0.01L}$=1.35×10-3g/L=1.35mg/L,
可知ClO2的浓度超标.
答:ClO2的浓度超标.
点评 本题考查二氧化氯的性质及应用,注意把握所给信息来分析解答,侧重学生解决新问题能力以及计算能力的考查,将知识活学活用为解答的关键,题目难度中等.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案| A. | 甲烷 | B. | 乙烯 | C. | 乙醇 | D. | 正丁烷 |
| A. | 石油的催化裂化和裂解 | B. | 煤的液化、气化和煤的干馏 | ||
| C. | 漂白的草帽久置于空气中变黄 | D. | 石油的分馏和海水蒸馏 |
| A. | (CH3)2CHOH | B. | (CH3)2C(C2H5)OH | C. | (CH3)3CCH2OH | D. | CH3C(C2H5)2OH |
| A. | 原混合气体中O2和CH4的体积比为2:1 | |
| B. | 残留物中只有Na2CO3 | |
| C. | 原混合气体中O2和CH4的物质的量之比为1:2 | |
| D. | 残留物只有Na2CO3和NaOH |
 试回答下列问题:
试回答下列问题: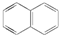 .萘的一氯代物有2种可能的结构,萘的六氯代物有10种可能的结构.
.萘的一氯代物有2种可能的结构,萘的六氯代物有10种可能的结构.