题目内容
18.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:I:实验需要90mL 0.1mol/LFeBr2溶液
(1)配制FeBr2溶液除烧杯、玻璃棒、量筒、外还需的玻璃仪器是胶头滴管、100ml的容量瓶.
(2)下列有关配制过程中说法正确的是aef(填序号).
a.洗涤溶解FeBr2的烧杯和玻璃棒,并将洗涤液转移至容量瓶中
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.用托盘天平称量质量为1.9g的FeBr2
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏低
f.容量瓶查漏后没有干燥就进行配制,结果无影响
II:探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色.某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+.
(3)请你完成表,验证假设:
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入适量苯,振荡、静置后 现象:CCl4层呈橙红色. | 假设1正确 |
| ②向溶液中加入KSCN溶液溶液 现象:溶液变为红色. | 假设2正确 |
请用一个离子方程式来证明:2Fe2++Br2=2Fe3++2Br-;
(5)若在50mL上述FeBr2溶液中通入5×10-3molCl2,则反应的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
分析 I.(1)配制FeBr2溶液时需要天平、钥匙、烧杯、玻璃棒、100ml的容量瓶,胶头滴管;
(2)a.洗涤溶解FeBr2的烧杯和玻璃棒,并将洗涤液转移至容量瓶中,保证溶质全部转移到容量瓶;
b.容量瓶不能作为溶解、储存溶液的仪器;
c.用电子天平称量质量为应为0.1×0.1×216=2.16g;
d.容量瓶不能储存溶液;
e.定容时,仰视容量瓶刻度线会使溶液体积增大;
f.容量瓶查漏后没有干燥就进行配制,结果无影响;
II.(3)假设1:Br-被C12氧化成Br2溶解在溶液中,通过溶液中加入适量四氯化碳,萃取出溴单质从而使CCl4层呈橙红色来证明有溴单质生成;假设2:Fe2+被C12氧化成Fe3+,向该溶液中加入KSCN溶液,溶液变为红色证明有三价铁生成;
(4)由还原性Fe2+>Br-,则氯化亚铁溶液中加入1~2滴溴水发生氧化还原反应生成Fe3+,反应为2Fe2++Br2=2Fe3++2Br-;
(5)还原性Fe2+>Br-,二者以1:1反应,由电子守恒可知,亚铁离子全部被氧化,溴离子一半被氧化;
解答 解:(1)配制FeBr2溶液时需要天平、钥匙、烧杯、玻璃棒、100ml的容量瓶,胶头滴管,则除烧杯、玻璃棒、量筒、外还需的玻璃仪器是胶头滴管、100ml的容量瓶,
故答案为:胶头滴管、100ml的容量瓶;
(2)a.洗涤溶解FeBr2的烧杯和玻璃棒,并将洗涤液转移至容量瓶中,保证溶质全部转移到容量瓶,故a正确;
b.容量瓶不能作为溶解、储存溶液的仪器,将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解是错误操作,故b错误;
c.用电子天平称量质量为应为0.1×0.1×216=2.16g,托盘天平只能称量到0.1g,故c错误;
d.容量瓶不能储存溶液,配制号的溶液应转移到试剂瓶中存放,故d错误;
e.定容时,仰视容量瓶刻度线会使溶液体积增大,测定结果偏低,故e正确;
f.容量瓶查漏后没有干燥就进行配制,水对测定结果无影响,故f正确;
故选aef,
故答案为:aef;
II.(3)假设1:Br-被C12氧化成Br2溶解在溶液中,通过溶液中加入适量四氯化碳,萃取出溴单质从而使CCl4层呈橙红色来证明有溴单质生成;假设2:Fe2+被C12氧化成Fe3+,向该溶液中加入KSCN溶液,溶液变为红色证明有三价铁生成;
故答案为:
| 实验步骤、预期现象 | 结论 |
| CCl4层呈橙红色 | |
| KSCN溶液,溶液变为红色 |
(4)由还原性Fe2+>Br-,还原剂还原性大于还原产物,则氯化亚铁溶液中加入1~2滴溴水发生氧化还原反应生成Fe3+,反应为2Fe2++Br2=2Fe3++2Br-,
故答案为:2Fe2++Br2=2Fe3++2Br-;
(5)还原性Fe2+>Br-,二者以1:1反应,由电子守恒可知,亚铁离子全部被氧化,溴离子一半被氧化,则等物质的量反应的离子反应为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故答案为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
点评 本题考查氧化还原反应及氧化性、还原性的比较、实验设计,学生应注意物质的性质及氧化还原反应中电子守恒来分析,题目难度中等.

 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案| A. | 加成反应 | B. | 酯化反应 | C. | 置换反应 | D. | 取代反应 |
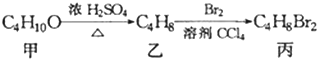 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )| A. | CH3CH(CH2Br)2 | B. | (CH3)2CBrCH2Br | C. | C2H5CHBrCH2Br | D. | CH3(CHBr)2CH3 |
| A. | 6.4g 铜与S完全反应,电子转移0.1 NA个 | |
| B. | 标准状况下,2.24 L水中含有0.1 NA个水分子 | |
| C. | 1.12 L氯气中含有0.1 NA个氯原子 | |
| D. | 0.1molNa2O2与足量的CO2反应转移的电子数为0.2NA |
| A. | Na、Mg、Al原子最外层电子数依次增多,其简单离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高 | |
| C. | C、N、O原子半径依次增大 | |
| D. | Na、K、Rb氧化物的水化物碱性依次增强 |
| A. | 一定有甲烷 | B. | 一定是甲烷和乙烯 | ||
| C. | 一定没有丙炔 | D. | 一定有乙炔 |
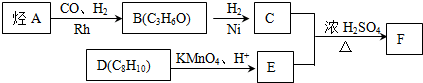
 .
.

 .
.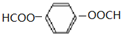 .
.