题目内容
20.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 苯酚能与溴水反应,苯不能与溴水反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯与溴蒸气(光照)发生取代反应,苯与液溴(铁做催化剂)发生取代反应 |
分析 A、苯环对酚羟基影响的结果是酚羟基具有酸性;
B、苯酚与溴水常温可以反应,而苯与溴水不能反应;
C、甲基连接在苯环上,可被氧化;
D、甲苯与溴蒸气(光照)发生取代反应,苯与液溴(铁做催化剂)发生取代反.
解答 解:A、在苯酚中,由于苯环对-OH的影响,酚羟基具有酸性,对比乙醇,虽含有-OH,但不具有酸性,能说明上述观点,故A错误;
B、苯酚和苯都含有苯环,但苯酚含有羟基,苯酚与溴水常温可以反应,而苯与溴水不能反应,可说明羟基对苯环有影响,故B错误;
C、甲基连接在苯环上,可被氧化,说明苯环对甲基影响,故C错误;
D、甲苯和苯都含有苯环,但甲苯与溴蒸气(光照)发生取代反应是甲基的性质,苯与液溴(铁做催化剂)发生取代反应是苯环上氢被取代,不能说明甲基对苯环有影响,故D正确;
故选D.
点评 本题考查有机物的结构和性质,题目难度不大,注意有机物的原子团之间相互影响的特点.

练习册系列答案
相关题目
10.红磷和白磷在一定条件下可以相互转化,这一变化属于( )
| A. | 氧化还原反应 | B. | 离子反应 | C. | 化学变化 | D. | 物理变化 |
11.下列说法中错误的是( )
| A. | 天然气是一种清洁的化石燃料 | |
| B. | 石油通过常压分馏可以得到石油气、汽油、煤油、柴油等 | |
| C. | 煤是由有机物和无机物组成的复杂的混合物 | |
| D. | 石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化 |
8.下列离子方程式正确的是( )
| A. | 过氧化钠固体与水反应:2O22-+2H2O═OH-+O2↑ | |
| B. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 稀硝酸与过量的铁屑反应Fe+4H-+NO3-═Fe3++NO↑+2H2O | |
| D. | NaAlO2溶液中通入过量二氧化碳AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓ |
5.分枝酸结构简式如图,下列说法正确的是( )


| A. | 分子式为C10H8O6 | |
| B. | 分子中含有3种官能团 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 1mol分枝酸最多可与3mol NaOH发生中和反应 |
12.锂原子比镁原子少1个电子层,最外层电子数也比镁原子少1,在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性.下列关于锂的判断可能正确的是( )
| A. | Li能在空气中燃烧 | B. | Li2O熔点较低 | ||
| C. | Li2CO3能溶于水 | D. | LiOH受热时易分解 |
9.下列有关说法正确的是( )
| A. | 铅蓄电池放电时,正极和负极的电极质量均增大 | |
| B. | 反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H<0 | |
| C. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 | |
| D. | C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变 |
4.乙苯催化脱氢生产苯乙烯的反应:
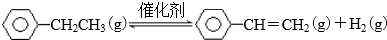
(1)一定温度下,将amol乙苯加入体积为VL的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如下表.
①平衡时,容器中气体物质的量总和为1.4amol,乙苯的转化率为40%.
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小
(3)实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示.[M=n(H2O)/n(乙苯]

①比较图中A、B两点对应平衡常数大小:KA<KB
②图中投料比(M1、M2、M3)的大小顺序为M1>M2>M3
③随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2(用化学方程式表示)
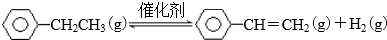
(1)一定温度下,将amol乙苯加入体积为VL的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如下表.
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/1000kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小
(3)实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示.[M=n(H2O)/n(乙苯]

①比较图中A、B两点对应平衡常数大小:KA<KB
②图中投料比(M1、M2、M3)的大小顺序为M1>M2>M3
③随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2(用化学方程式表示)

