题目内容
16.查阅资料:无水醋酸钠是无色无味的结晶体,在空气中可被风化,可燃.用无水醋酸钠与碱石灰加热可以制得X气体,并进行相应的实验:
(1)装置E中反应方程式是CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+X↑,X的化学式是CH4.
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①C装置所盛放液体试剂是饱和食盐水;
②B装置的作用是除去Cl2中含有的HCl;光照后所得产物有5种;
③装置D的作用是连通大气,平衡压强;接收可能溢出的液体;
(3)某学生为了测定X的组成进行实验探究,选用了F、G、H仪器:
①该同学依次连接的合理顺序是E、G、H、F;
②该同学测定的相关数据是:
| 装置 | 实验前的质量/g | 实验后的质量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
由以上数据可知X中碳氢两种原子的物质的量之比>(选填“>”、“<”)1:4,造成这种结果的原因是F 装置后面与空气接触,空气中的水蒸气和CO2进入了F 装置,造成含碳量偏大.
分析 (1)依据原子守恒判断产物的化学式;
(2)装置A是氯气发生装置,生成的氯气中含氯化氢气体,需要通过饱和食盐水除去,装置E是甲烷气体发生装置,氯气和甲烷按照1:1体积混合光照发生取代反应,装置C中是饱和食盐水减少氯气的溶解,使甲烷和氯气混合均匀,反应得到四种取代产物和氯化氢气体,通过D使C连通大气,平衡压强,接收可能溢出的液体;
(3)①为了测定X为CH4的组成,利用装置E制备甲烷,得到气体通过装置G中的氧化铜反应,用浓硫酸吸收生成水,用碱石灰吸收生成的二氧化碳;
②实验数据只能计算碳和氢元素物质的量之比,不能确定是否含氧元素;
F中吸收的是CO2,CO2质量33.6g-22.5g=11.1g,n(C)=$\frac{11.1g}{44g/mol}$=0.252mol;H 中吸收的是水蒸气,H2O质量5 1.4g-42.4g=9.0g,n(H)=$\frac{9g}{18g/mol}$×2=1.0mol;故n(C):n(H)>1:4,碱石灰会吸收空气中二氧化碳、水蒸气导致误差产生.
解答 解:(1)装置E中反应方程式是CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+X↑,由原子守恒,可知X的化学式是CH4,
故答案为:CH4;
(2)装置A是氯气发生装置,生成的氯气中含氯化氢气体,需要通过饱和食盐水除去,装置E是甲烷气体发生装置,氯气和甲烷按照1:1体积混合光照发生取代反应,装置C中是饱和食盐水减少氯气的溶解,使甲烷和氯气混合均匀,反应得到四种取代产物和氯化氢气体,通过D使C连通大气,平衡压强,接收可能溢出的液体;
①C装置中盛有饱和食盐水,故答案为:饱和食盐水;
②B装置的作用是除去Cl2中含有的HCl,光照后氯气和甲烷发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷和氯化氢,故答案为:除去Cl2中含有的HCl;5;
③装置D的作用是:连通大气,平衡压强;接收可能溢出的液体,故答案为:连通大气,平衡压强;接收可能溢出的液体;
(3)①为了测定X为CH4的组成,利用装置E制备甲烷,得到气体通过装置G中的氧化铜反应,生成水和二氧化碳,用浓硫酸吸收生成水,用碱石灰吸收生成的二氧化碳,装置连接顺序为EGHF,
故答案为:G、H、F;
②实验数据只能计算碳和氢元素物质的量之比,不能确定是否含氧元素,所以应依据质量守恒分析判断是否含氧元素,需要称取C装置实验前后的质量;
F中吸收的是CO2,CO2质量33.6g-22.5g=11.1g,n(C)=$\frac{11.1g}{44g/mol}$=0.252mol;H 中吸收的是水蒸气,H2O质量5 1.4g-42.4g=9.0g,n(H)=$\frac{9g}{18g/mol}$×2=1.0mol;故n(C):n(H)>1:4,所以计算结果可知测得有误差,原因是F 装置后面与空气接触,空气中的水蒸气和CO2 进入了F 装置,造成含碳量偏大,
故答案为:数据是不完全,因为只能确定有机物中的碳氢元素含量,不能确定是否含有氧元素,应称取C 装置实验前后的质量;F 装置后面与空气接触,空气中的水蒸气和CO2进入了F 装置,造成含碳量偏大.
点评 本题考查了物质性质实验分析和实验方案设计,主要是物质组成的实验测得方法,掌握实验基础和物质性质是解题关键,题目难度中等.

| A. | Li能在空气中燃烧 | B. | Li2O熔点较低 | ||
| C. | Li2CO3能溶于水 | D. | LiOH受热时易分解 |
| 实验序号 | ① | ② | ③ |
| 加入试剂(取等体积溶液) | 0.01mol/LKMnO4 0.1mol/LH2C2O4 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 MnSO4固体 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 Na2SO4固体 |
| 褪色时间/s | 116 | 6 | 117 |
(1)该实验结论是在其他条件相同时,Mn2+是草酸与酸性高锰酸钾反应的催化剂,起着加快反应速率的作用.
(2)还可以控制变量,研究哪些因素对该反应速率的影响:温度、浓度等.
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论.请你写出实验①的现象并分析产生该现象的原因:KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速率.
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是酸性KMnO4溶液具有强氧化性,能氧化氯化锰中的氯离子,也会使KMnO4溶液褪色,产生干扰.
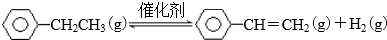
(1)一定温度下,将amol乙苯加入体积为VL的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如下表.
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/1000kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小
(3)实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示.[M=n(H2O)/n(乙苯]

①比较图中A、B两点对应平衡常数大小:KA<KB
②图中投料比(M1、M2、M3)的大小顺序为M1>M2>M3
③随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2(用化学方程式表示)
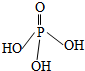 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )| A. | 三聚磷酸中P的化合价为+5 | |
| B. | 三聚磷酸钠的化学式为Na3P3O10 | |
| C. | 按上述原理,四聚磷酸的化学式为H6P4O13 | |
| D. | 多聚磷酸的结构可表示为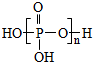 |
| A. | 砷元素的最高化合价为+3 | B. | 砷元素是第四周期第VA族的元素 | ||
| C. | 砷原子的M电子层有8个电子 | D. | 砷的氧化物的水溶液呈强碱性 |
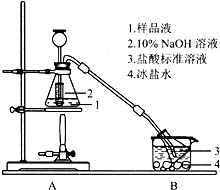 Cux(NH3)y(SO4)z•nH2O是深蓝色晶体,可溶于水,不溶于乙醇、乙醚等有机溶剂,常用作杀虫剂、媒染剂等.某小组利用废铜屑、硫酸、氨水等原料制备该晶体并测定其组成.
Cux(NH3)y(SO4)z•nH2O是深蓝色晶体,可溶于水,不溶于乙醇、乙醚等有机溶剂,常用作杀虫剂、媒染剂等.某小组利用废铜屑、硫酸、氨水等原料制备该晶体并测定其组成.