题目内容
9. 高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程:
高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程: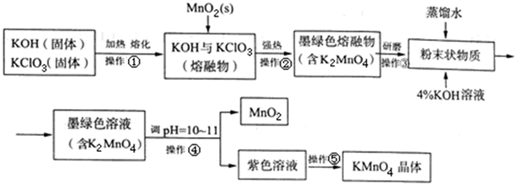
(1)操作①②目的是获得K2MnO4,同时还产生了KCl和H2O,试写出该步反应的化学方程式:KClO3+3MnO2+6KOH $\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O↑.
(2)操作④是使K2MnO4转化为KMnO4和MnO2,需要通入某种气体调pH=10~11,在实际操作中一般选择CO2而不是HCl,原因是Cl-具有还原性,可将K2MnO4和KMnO4还原.
 (3)操作④、⑤要用到抽滤装置,仪器B的名称是抽滤瓶,相比普通的过滤,该装置的突出优点是过滤速度快、效果好.
(3)操作④、⑤要用到抽滤装置,仪器B的名称是抽滤瓶,相比普通的过滤,该装置的突出优点是过滤速度快、效果好.(4)准确称取0.4000g产品放于锥形瓶中,加适量蒸馏水溶解,并加稀硫酸酸化.用0.2000mol•L-1 的Na2C2O4标准溶液滴定至终点时消耗20.00mL.则产品中KMnO4的质量分数为63.2%.(保留4位有效数字,不考虑杂质参与反应)后续的平行实验中,下列滴定操作会导致测量结果偏高的是D.
A.锥形瓶洗涤后没有干燥 B.滴定时锥形瓶中有液体溅出
C.滴定终点读数时俯视 D.滴定管滴定前有气泡,滴定后气泡消失.
分析 在碱性条件下氯酸钾与二氧化锰加热熔融发生氧化还原反应,二氧化锰被氧化成锰酸钾,溶于水得墨绿色K2MnO4溶液,K2MnO4溶液中加入氢氧化钾溶液再调节PH值为10~11,使MnO42-发生歧化反应,生成MnO4-和MnO2,趁热过滤除去二氧化锰,得高锰酸钾溶液,冷却结晶得高锰酸钾晶体,
(1)在碱性条件下氯酸钾与二氧化锰加热熔融发生氧化还原反应,生成K2MnO4,同时还产生了KCl和H2O,根据元素守恒书写化学方程式;
(2)操作④是使MnO42-发生歧化反应,生成MnO4-和MnO2,若溶液碱性过强,则MnO4-又会转化为MnO42-和氧气,在调节PH值时,如果用盐酸会被高锰酸钾氧化成氯气,所以不能用盐酸调节PH值;
(3)仪器B为抽滤瓶,抽滤与过滤相比,抽滤速度快、效果好,据此选择;
(4)先根据数据的有效性求出消耗的高锰酸钾溶液的体积,再根据反应5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O,则5C2O42-~2MnO4-,计算KMnO4的质量分数,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:在碱性条件下氯酸钾与二氧化锰加热熔融发生氧化还原反应,二氧化锰被氧化成锰酸钾,溶于水得墨绿色K2MnO4溶液,K2MnO4溶液中加入氢氧化钾溶液再调节PH值为10~11,使MnO42-发生歧化反应,生成MnO4-和MnO2,趁热过滤除去二氧化锰,得高锰酸钾溶液,冷却结晶得高锰酸钾晶体,
(1)在碱性条件下氯酸钾与二氧化锰加热熔融发生氧化还原反应,生成K2MnO4,同时还产生了KCl和H2O,反应的化学方程式为:KClO3+3MnO2+6KOH $\frac{\underline{\;高温\;}}{\;}$ 3K2MnO4+KCl+3H2O↑,
故答案为:KClO3+3MnO2+6KOH $\frac{\underline{\;高温\;}}{\;}$ 3K2MnO4+KCl+3H2O↑;
(2)操作④是使MnO42-发生歧化反应,生成MnO4-和MnO2,反应的离子方程式为3MnO42-+2H2O=2MnO4-+MnO2↓+4OH-,若溶液碱性过强,则MnO4-又会转化为MnO42-和氧气,反应的离子方程式为 3MnO42-+2H2O=2MnO4-+MnO2↓+4OH-,在调节PH值时,Cl-具有还原性,可将K2MnO4和KMnO4还原,所以如果用盐酸会被高锰酸钾氧化成氯气,故不能用盐酸调节PH值,
故答案为:Cl-具有还原性,可将K2MnO4和KMnO4还原;
(3)装置图中仪器形状可知B为抽滤瓶,抽滤与过滤相比,抽滤速度快、效果好,所以用抽滤不用过滤,
故答案为:抽滤瓶;过滤速度快、效果好;
(4)先根据数据的有效性求出消耗的高锰酸钾溶液的体积,再根据反应5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O,准确称取0.4000g产品放于锥形瓶中,加适量蒸馏水溶解,并加稀硫酸酸化.用0.2000mol•L-1 的Na2C2O4标准溶液滴定至终点时消耗20.00mL.
则5C2O42-~~~~~~2MnO4-,
5 2
0.2000mol•L-1×0.0200L n=$\frac{2}{5}$×0.0040mol=0.0016mol
产品中KMnO4的质量分数=$\frac{0.0016mol×158g/mol}{0.4000g}$×100%=63.2%,
根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,
A.锥形瓶洗涤后没有干燥对测定结果无影响,故A错误;
B.滴定时锥形瓶中有液体溅出导致测定结果偏低,B错误;
C.滴定终点读数时俯视,导致标准溶液体积减少,测定结果偏低,故C错误;
D.滴定管滴定前有气泡,滴定后气泡消失,读取标准溶液的体积增大,导致测定结果偏高,故D正确;
故答案为:63.2%;D;
点评 本题考查了制备实验中的有关知识,题目难度不大,明确常用消毒剂的消毒原理、化学试剂的存放等知识点,注意滴定实验的过程分析和数值计算.

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案| A. | 溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 将制得的晶体转移到新制过滤器中用大量水进行洗涤 | |
| D. | 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 |
| A. | 大力实施矿物燃料的脱硫脱硝技术可以减少SO2、NOx的排放 | |
| B. | PM2.5是直径≤2.5微米的细颗粒物,其表面积大,易附带有毒有害物质 | |
| C. | O3能消毒杀菌,空气中O3浓度越大越有利于人体健康 | |
| D. | 汽车尾气中的CO主要来自汽油的不完全燃烧 |
| A. | 2NO2?N2O4 (正反应为放热反应) | |
| B. | C(s)+CO2?2CO (正反应为吸热反应) | |
| C. | N2+3H2?2NH3 (正反应为放热反应) | |
| D. | H2S?H2+S(s) (正反应为吸热反应) |
| A. | 等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |

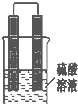 甲同学想利用原电池反应检测金属的活动性顺序,他使用镁片与铝片作电极,放入 稀H2SO4溶液中,如图所示•
甲同学想利用原电池反应检测金属的活动性顺序,他使用镁片与铝片作电极,放入 稀H2SO4溶液中,如图所示•