题目内容
14.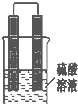 甲同学想利用原电池反应检测金属的活动性顺序,他使用镁片与铝片作电极,放入 稀H2SO4溶液中,如图所示•
甲同学想利用原电池反应检测金属的活动性顺序,他使用镁片与铝片作电极,放入 稀H2SO4溶液中,如图所示•①写出电池中正极的电极反应式和总反应的离子方程式:
正极:2H++2e-=H2↑.
总反应的离子方程式:2H++Mg=Mg2++H2↑.
②根据实验现象甲同学判断出Mg活动性更强 (填写元素符号).
分析 硫酸作电解质,镁比铝活泼,镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;
解答 解:①镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,负极反应为Mg-2e-=Mg2+,正极反应为2H++2e-=H2↑,总的离子反应方程式为:2H++Mg=Mg2++H2↑,故答案为:2H++2e-=H2↑;2H++Mg=Mg2++H2↑;
②根据实验现象铝的表面产生气体,所以甲同学判断出镁活动性更强,故答案为:Mg.
点评 本题考查金属活泼性及探究原电池原理,为高频考点,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极为易错点,题目难度中等.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
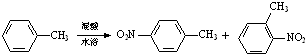
5. 常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.
实验中可能用到的数据:
实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
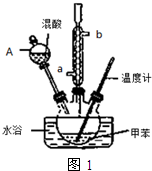
②在三颈瓶中加入13g甲苯(易挥发),按图1所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制水浴温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15g.
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许沸石(或碎瓷片),目的是防止暴沸.
(2)冷凝管的作用是冷凝回流;冷却水从冷凝管的a(填“a”或“b”)端进入.
(3)仪器A的名称是分液漏斗,使用该仪器前必须进行的操作是检查是否漏液.
(4)分离反应后产物的方案如图2:

其中,操作1的名称为分液,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和蒸馏烧瓶、冷凝管.
(5)该实验中一硝基甲苯的产率为77.5%(保留三位有效数字).
 常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.
实验中可能用到的数据:
| 密度/g?cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
②在三颈瓶中加入13g甲苯(易挥发),按图1所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制水浴温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15g.
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许沸石(或碎瓷片),目的是防止暴沸.
(2)冷凝管的作用是冷凝回流;冷却水从冷凝管的a(填“a”或“b”)端进入.
(3)仪器A的名称是分液漏斗,使用该仪器前必须进行的操作是检查是否漏液.
(4)分离反应后产物的方案如图2:

其中,操作1的名称为分液,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和蒸馏烧瓶、冷凝管.
(5)该实验中一硝基甲苯的产率为77.5%(保留三位有效数字).
2.下列说法正确的是( )
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 吸热反应一定需要加热才能发生 | |
| C. | 凡是放热反应的发生均无需加热 | |
| D. | 物质发生化学反应都伴随着能量变化 |
19.某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0.下列叙述中,正确的是( )
| A. | 加入少量W,逆反应速率增大 | |
| B. | 当容器中气体压强不变时,反应达到平衡 | |
| C. | 升高温度,平衡逆向移动 | |
| D. | 改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大 |
6.在一定温度下将CO和水蒸气各1mol放在密闭容器中反应:CO+H2O?CO2+H2,达平衡后测得CO2为0.6mol.再通入4mol水蒸气,达到新的平衡后,CO2的物质的量为( )
| A. | 0.6 mol | B. | 1 mol | ||
| C. | >1 mol | D. | 0.6 mol<n(CO2)<1 mol |
3.向CH3COONa稀溶液中分别加入少量下列物质或改变如下条件,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$一定减小的是( )
①NaOH固体②NaHSO4固体 ③氯化钠水溶液④CH3COONa固体 ⑤冰醋酸⑥降低温度.
①NaOH固体②NaHSO4固体 ③氯化钠水溶液④CH3COONa固体 ⑤冰醋酸⑥降低温度.
| A. | ①③④ | B. | ②③⑤ | C. | ②⑤⑥ | D. | ①④⑥ |
4.下列液体中,滴入水中会出现分层现象,但在滴入热的氢氧化钠溶液中时分层现象会逐渐消失的是(不考虑有机物的挥发)( )
| A. | 溴乙烷和乙酸乙酯 | B. | 乙醇和乙酸 | ||
| C. | 乙醇和乙酸乙酯 | D. | 苯乙烯和氯甲烷 |
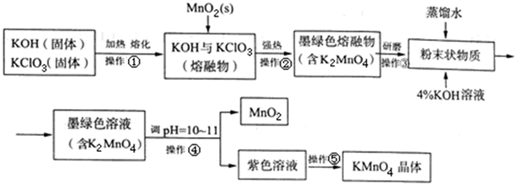
 高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程:
高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程: