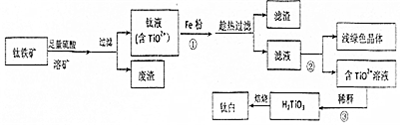
题目内容
10.下列叙述中,正确的是( )| A. | 所有主族中都有非金属元素 | |
| B. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| C. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| D. | 元素周期表中从ⅢB到ⅡB 10个纵列的元素都是金属元素 |
分析 A.第IIA均为金属元素;
B、同周期元素中,从左往右原子半径逐渐减小;
C、原子半径越大,失电子能力越强;
D.过渡元素都是金属元素.
解答 解:A.第IIA均为金属元素,其它主族均含非金属元素和金属元素,故A错误;
B、同周期元素中,从左往右原子半径逐渐减小,所以同周期元素中,ⅦA族元素的原子半径最小,故B错误;
C、原子半径越大,失电子能力越强,所以ⅥA族元素的原子,其半径越大,越容易失电子,故C错误;
D.元素周期表中从ⅢB族到ⅡB族这10个纵列为过渡元素,都是金属元素,故D正确,
故选D.
点评 本题考查元素周期表与元素周期律,比较基础,注意整体把握元素周期表的结构、理解元素周期律.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.现有三种元素的基态原子的电子排布式如下
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
| A. | 第一电离能:③>②>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:③>①>② | D. | 最高化合价:②>①>③ |
1.(非实验班做)如图所示的实验,能达到实验目的是( )
| A | B | C | D |
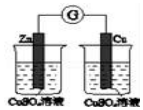 | 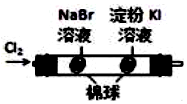 | 将稀盐酸与碳酸钠 溶液混合 | 5%的H2O2溶 液中滴入2滴 1molL-1氯化 铁溶液 |
| 验证化学能 转化为电能 | 验证氧化性Cl2>Br2>I2 | 验证氯比氮的非金属性强 | 验证催化剂加快 反应速率 |
| A. | A | B. | B | C. | C | D. | D |
18.在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g),所得实验数据如表:下列说法错误的是( )
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.10 | 0.10 | 0.09 |
| ② | 800 | 0.20 | 0.20 | 0.10 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A. | 实验①中,若5min时测得n(M)=0.05mol,则0至5min时间内,用N表示的平均反应速率v(N)=0.01 mol/( L•min) | |
| B. | 实验②中,该反应的平衡常数K=1.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 实验④中,达到平衡时,b>0.06 |
15.化学在生产和日常生活中有着重要的作用,下列说法错误的是( )
| A. | 即将发射的嫦娥五号卫星使用的碳纤维是一种新型无机非金属材料 | |
| B. | 我国古代闻名于世界的化学工艺有烧陶瓷、造纸、冶金、制火药等 | |
| C. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的氮氧化物 | |
| D. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 |
2.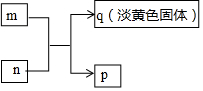 X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )
X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )
 X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )
X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )| A. | 原子半径:Z>W>Y>X | |
| B. | 简单氢化物的稳定性:Y>W | |
| C. | m、n、p均为只含极性键的共价化合物 | |
| D. | Z、W形成的化合物可由两种盐溶液通过复分解反应制得 |
19.化学与生产、生活、社会发展息息相关.下列说法正确的是( )
| A. | 食品包装时放入盛有还原铁粉的透气小袋可防止食品氧化变质 | |
| B. | 聚乙烯、聚氯乙烯均可作为包装材料,且不会造成环境污染 | |
| C. | 华为自主研发的“麒麟”芯片与光导纤维是同种材料 | |
| D. | 小苏打能作焙制蛋糕的膨松剂是由于小苏打能与碱反应生成CO2 |
14.下列关于胶体的叙述中正确的是( )
| A. | 胶体是一种液态混合物,属于分散系的一种 | |
| B. | 用丁达尔效应可区分Fe(OH)3胶体、水、CuSO4溶液 | |
| C. | 用过滤器可以将胶体和溶液分开 | |
| D. | 胶体的本质特征是发生丁达尔效应 |