题目内容
17.下列有关金属单质的叙述中,正确的是( )| A. | 活泼金属在空气中易与氧气反应,都能在其表面形成一层致密的氧化膜 | |
| B. | 钠比铜的活泼性强,所以钠投入到CuSO4溶液中可置换出单质铜 | |
| C. | 等质量的铝粉分别与足量的盐酸或NaOH溶液完全反应时,产生的气体质量相等 | |
| D. | 用铁制或铝制容器来盛装浓硝酸,是因为Fe或Al不能与冷的浓硝酸发生反应 |
分析 A.Al与氧气反应生成致密的氧化膜;
B.钠与盐溶液反应时,先与水反应;
C.足量的盐酸或NaOH溶液,Al完全反应,等质量的Al失去电子相同;
D.Fe、Al遇浓硝酸发生钝化,生成致密的氧化膜.
解答 解:A.Al与氧气反应生成致密的氧化膜,活泼金属易失去电子,则在空气中易与氧气反应,但氧化膜不一定为致密的结构,故A错误;
B.钠与盐溶液反应时,先与水反应,则钠投入到CuSO4溶液中生成氢氧化铜沉淀、硫酸钠、氢气,故B错误;
C.足量的盐酸或NaOH溶液,Al完全反应,等质量的Al失去电子相同,则H得电子相同,所以产生的气体质量相等,故C正确;
D.Fe、Al遇浓硝酸发生钝化,生成致密的氧化膜,阻止反应进一步发生,则用铁制或铝制容器来盛装浓硝酸,故D错误;
故选C.
点评 本题考查金属及化合物的性质,为高频考点,把握金属的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意选项B、D为易错点,题目难度不大.

练习册系列答案
相关题目
8. 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲、乙两烧杯中溶液的pH均保持不变 | |
| B. | 甲烧杯a电极反应式为:4OH--4e-═O2↑+2H2O | |
| C. | 电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 | |
| D. | 当b极增重3.2g时,d极产生的气体为2.24L(标准状况下) |
5.银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-;总反应为:Ag2O+Zn═2Ag+ZnO,下列判断正确的是( )
| A. | 锌为正极,Ag2O为负极 | B. | 锌为阳极,Ag2O为阴极 | ||
| C. | 原电池工作时,负极区PH减小 | D. | 原电池工作时,负极区PH增大 |
12.下列反应不属于氧化还原反应的是( )
| A. | Na2O+H2O=2NaOH | B. | Zn+H2SO4=ZnSO4+H2↑ | ||
| C. | 2Na+Cl2=2NaCl | D. | Cl2+2KI=2KCl+I2 |
2.下列关于燃料电池的说法正确的是( )
| A. | 燃料电池只能在燃烧的情况下才能发生 | |
| B. | 燃料电池是将化学能转化为电能的装置 | |
| C. | 燃料电池属于二次电池的一种 | |
| D. | 燃料电池与燃料燃烧时对能量的转化率完全相同 |
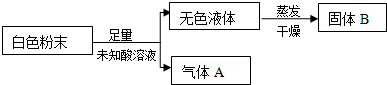
5.甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,可以发生如图转化,下列说法不正确的是( )


| A. | 在甲中滴加丁可能发生反应:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| B. | 溶液丙中还可以大量共存的离子有:I-、NO3-、SO42- | |
| C. | 白色沉淀A可能溶解在溶液D中 | |
| D. | 甲为NaHCO3,乙为 AlCl3 |
3.在过滤实验操作中,不需要用到的仪器是( )
| A. | 玻璃棒 | B. | 胶头滴管 | C. | 烧杯 | D. | 漏斗 |
 .
.