题目内容
6.标准状况下,2mol H2的体积是( )| A. | 11.2mL | B. | 44.8mL | C. | 22.4mL | D. | 44.8L |
分析 标准状况下,Vm=22.4L/mol,根据V=nVm计算标况下2mol H2占有的体积.
解答 解:标准状况下,Vm=22.4L/mol,标况下2mol H2占有的体积V=nVm=2mol×22.4L/mol=44.8L,
故选D.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算公式,有利于基础知识的巩固,该题注意气体摩尔体积的应用,题目较简单.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
16.在冰晶石(Na3[AlF6])晶胞中,[AlF6]3-占据的位置相当于NaCl晶胞中Cl-占据的位置,则冰晶石晶胞中含有的原子数与NaCl晶胞中含有的原子数之比为( )
| A. | 2:1 | B. | 3:2 | C. | 5:2 | D. | 5:1 |
14.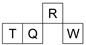 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 原子半径:T>Q>R | |
| C. | 最高价氧化物对应水化物的酸性:Q<W | |
| D. | 含T元素的盐溶液一定显酸性 |
1.有一位学生将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),可能观察到的现象是( )
| A. | 那浮在试管中的液面上 | B. | 钠沉入试管底部 | ||
| C. | 钠燃烧起来 | D. | 钠处于煤油和水的交界处 |
18.银氨溶液可用于检测CO气体,实验室研究的装置如图:
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的脱水性性.
(2)装置A中软管的作用是恒压,使甲酸溶液能顺利滴下.
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10.
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体.
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象.
①实验c的目的是对比试验,排除银氨溶液对产物检验的干扰.
②根据上述实验现象判断,上层清液中产物成分为(NH4)2CO3(填化学式).
(4)设计实验证明黑色固体的成分是Ag:可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液.
取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl溶液,能产生白色沉淀,说明黑色固体是Ag单质.(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①写出生成AgCl沉淀的离子反应[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O.
②若该反应中消耗3.3g羟氨,理论上可得银的质量为10.8g.
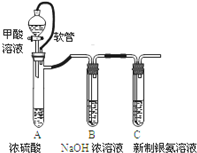 | 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用. |
(2)装置A中软管的作用是恒压,使甲酸溶液能顺利滴下.
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10.
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体.
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象.
①实验c的目的是对比试验,排除银氨溶液对产物检验的干扰.
②根据上述实验现象判断,上层清液中产物成分为(NH4)2CO3(填化学式).
(4)设计实验证明黑色固体的成分是Ag:可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液.
取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl溶液,能产生白色沉淀,说明黑色固体是Ag单质.(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①写出生成AgCl沉淀的离子反应[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O.
②若该反应中消耗3.3g羟氨,理论上可得银的质量为10.8g.
15.能证明BF3为平面三角形而不是三角锥形分子的理由是( )
| A. | BF2Cl只有一种结构 | B. | 三根B-F键间键角都为120° | ||
| C. | BFCl2只有一种结构 | D. | 三根B-F键键长都为130pm |
16.500℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
下列说法正确的是( )
| 反应时间min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 增大压强对正逆反应速率没有影响,平衡不移动 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O(g),达到平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | |
| D. | 由表格中数据得出,t1时刻该反应还未达到平衡 |