题目内容
17.氮元素可以形成多种化合物.请回答以下问题:(1)基态氮原子的价电子排布图是2s22p3.
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①请用价电子层对互斥理论推测NH3分子的空间构型是三角锥型,其中H-N-H的键角为107°18′.请根据价层电子对互斥理论解释其键角小于109°28′的原因:NH3分子含有1个孤电子对,孤电子对影响键角.
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ•mol-1
若该反应中有4mol N-H 键断裂,则形成π 键的数目为3.
(3)比较氮的简单氢化物与同族第三、四周期元素所形成氢化物的沸点高低并说明理由:NH3>AsH3>PH3,NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高.
分析 (1)N原子核外有7个电子,最外层有5个电子,根据构造原理顺序其价电子排布式;
(2)①根据价层电子对互斥理论确定分子空间构型;NH3分子含有1个孤电子对,NH3中N-H键之间的夹角为107°18′;②根据-H键与π键的关系式计算;
(3)同一主族元素中,氢化物的沸点随着相对分子质量的增大而增大,但含有氢键的氢化物的沸点较大.
解答 解:(1)氮原子的电子排布式1s22s22p3,其价层电子排布式为2s22p3,
故答案为:2s22p3;
(2)①NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥型,平面正三角形键角应该为120°,NH3分子含有1个孤电子对,孤电子对影响键角,其键角为107°18′,
故答案为:三角锥型;107°18′;NH3分子含有1个孤电子对,孤电子对影响键角;
②1mol氮气分子中含有2molπ键,若该反应中有4molN-H键断裂,即有1mol肼参加反应,生成1.5mol氮气,所以形成的π键有1.5mol×2=3mol,
故答案为:3;
(3)N元素非金属性较强,对应的氢化物含有氢键,沸点较高;在同主族元素对应的氢化物中AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高,则沸点大小为:NH3>AsH3>PH3,
故答案为:NH3>AsH3>PH3,NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高.
点评 本题考查了原子结构和性质,涉及价电子排布图、分子空间结构类型的判断、原子杂化方式的判断、氢键等知识点,这些都是考试热点,要重点掌握,该题难度中等.

练习册系列答案
相关题目
7.下列分子中所有原子不可能共平面的是( )
| A. |  | B. | CF2═CF2 | C. | CH≡C-CH═CH2 | D. |  |
8.国际上至今发现具有巨磁电阻效应的20多种金属纳米多层膜中,其中三种是我国学者发现的,Mn和Bi形成的晶体薄膜是一种金属间化合物(晶胞结构如图),有关说法正确的是( )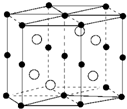

| A. | 锰价电子排布为3d74s0 | B. | Bi是d区金属 | ||
| C. | 该晶体的化学式为MnBi | D. | 该合金堆积方式是简单立方 |
5.下列分子结构中,所有原子都满足最外层为8电子结构的是( )
| A. | 氯化硫(S2Cl2) | B. | 次氯酸 | C. | 六氟化氙 | D. | 三氟化硼 |
12.下列说法正确的是( )
| A. | 分子晶体在水中溶解时,只破坏分子间作用力 | |
| B. | 原子晶体中的各相邻原子都以非极性键相结合 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 含有金属阳离子的晶体不一定是离子晶体 |
9.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知;人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③已知上述工业固氮反应的反应热△H=-92kJ/mol,1molN2、1molH2分子中的化学键断裂所吸收的能量分别为946kJ、436kJ,则N-H键断裂所吸收的能量为391kJ/mol.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较p1、p2的大小关系:р2>р1.

(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知;人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③已知上述工业固氮反应的反应热△H=-92kJ/mol,1molN2、1molH2分子中的化学键断裂所吸收的能量分别为946kJ、436kJ,则N-H键断裂所吸收的能量为391kJ/mol.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较p1、p2的大小关系:р2>р1.

6.标准状况下,2mol H2的体积是( )
| A. | 11.2mL | B. | 44.8mL | C. | 22.4mL | D. | 44.8L |
7.某溶液中只可能含有K+、Mg2+、Al3+、Br-、OH-、CO32-、SO32-中的一种或几种.取样,滴加足量氯水,有气泡产生,溶液变为橙色;向橙色溶液中加BaCl2溶液无明显现象.为确定该溶液的组成,还需进行的实验是( )
| A. | 取样,进行焰色反应 | |
| B. | 取样,滴加酚酞试液 | |
| C. | 取样,加入足量稀HNO3,再滴加AgNO3溶液 | |
| D. | 取样,加入足量BaCl2溶液,再滴加紫色石蕊试液 |
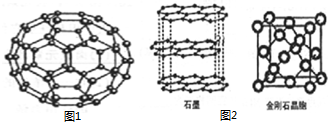 C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.
C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.