题目内容
5.金属具有良好的导电、导热及延展性等,因此广泛应用于制造各种材料.请回答下列问题:(1)下列关于自行车金属部件的防腐措施 不正确的是D(填标号).
A.为车架、挡泥板、车后座、车座弹簧烤上一层漆
B.为链条涂上机油,为轴承涂上凡士林
C.对车把、车圈、车辐条进行电镀处理
D.把自行车存放在阴凉、潮湿的地方
(2)家庭中“钢精锅”是由铝合金做成的,它能长期使用的原因是
铝表面形成一层致密的氧化膜,阻止内部金属进一步被氧化.
(3)某合金和铁的有关性质如下表:
| 熔点/℃ | 密度/g.cm-3 | 硬度 | 导电性 | |
| 某合金 | 2500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1535 | 7.86 | 4.5 | 17 |
A.导线 B.门窗框 C.炉具 D.飞机外壳.
分析 (1)对自行车金属部件进行防腐,可以涂油、喷漆、牺牲阳极的阴极保护法、外加电源的阴极保护法、电镀等;
(2)根据铝及其氧化物的性质分析,注意铝是亲氧元素;
(3)从表中可看出某合金的熔点高,密度小,硬度大,导电性差.
解答 解:(1)A.为车架、挡泥板、车后座、车座弹簧烤上一层漆,可以隔绝空气和水,从而达到防腐的目的,故A正确;
B.为链条涂上机油,为轴承涂上凡士林,能隔绝空气和水,从而达到防腐的目的,故B正确;
C.对车把、车圈、车辐条进行电镀处理,能隔绝空气和水,从而达到防腐的目的,故C正确;
D.把自行车存放在阴凉、潮湿的地方,自行车更易腐蚀,故D错误.
故选D;
(2)铝是亲氧元素,在空气中极易和氧气反应生成的氧化铝保护膜,阻止了铝的进一步反应,从而达到保护的目的,
故答案为:铝表面形成一层致密的氧化膜,阻止内部金属进一步被氧化;
(3)A.合金的导电性差,不能做导线,故A选;
B.框合金的硬度大,可做门窗框,故B不选;
C.合金的熔点高,可做炉具故C不选;
D.合金密度小可作飞机外壳,故D不选;
故选A.
点评 本题较为综合,主要考查了钢铁的防腐、合金的特点和用途等知识,题目难度不大,平时需注意基础知识的积累.

练习册系列答案
相关题目
13.下列有关硬水的说法中,不正确的是( )
| A. | 含有较多钙、镁离子的水叫做硬水 | |
| B. | 软水中不含有钙、镁离子 | |
| C. | 可以采取加热煮沸法和离子交接法软化硬水 | |
| D. | 硬水会降低肥皂的洗涤效果 |
10.某元素R的阴离子Rn-核外有a个电子,中子数为b,则其质量数为( )
| A. | b+n | B. | b+a+n | C. | b+a-n | D. | b-a+n |
17.能与NaOH(固体)、CuCl2(固体)、液氯归为一类的是( )
| A. | 浓盐酸 | B. | 大理石 | C. | 氢气 | D. | 饱和食盐水 |
14.根据下图海水综合利用的工业流程图,判断下列说法错误的是( )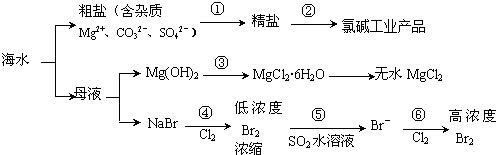

| A. | 过程①需要加入不止1种试剂,并通过合适的操作,方能把杂质除去 | |
| B. | 过程②得到的氯碱工业产品中只含有1种单质 | |
| C. | 过程③发生复分解反应 | |
| D. | 过程④、⑤、⑥均发生氧化还原反应 |
15.钢铁产量可以衡量一个国家重工业的发展水平.已知工业冶炼铁的过程中可能发生反应的热化学方程式如下:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3
④C(s)+O2(g)=CO2(g)△H4
⑤C(s)+CO2(g)=2CO(g)△H5
⑥FeO(s)+CO(g)=Fe(s)十CO2(g)△H6
下列推断不正确的是( )
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3
④C(s)+O2(g)=CO2(g)△H4
⑤C(s)+CO2(g)=2CO(g)△H5
⑥FeO(s)+CO(g)=Fe(s)十CO2(g)△H6
下列推断不正确的是( )
| A. | △H4<0,△H5>0 | |
| B. | △H6=$\frac{{△H}_{1}×3-{△H}_{2}-{△H}_{3}×2}{6}$ | |
| C. | 2CO(g)+O2(g)=2CO2(g)△H=$\frac{{△H}_{4}-{△H}_{3}}{2}$ | |
| D. | 2Fe3O4(s)+$\frac{1}{2}$O2(g)=3Fe2O3(s)△H=$\frac{{△H}_{4}-{△H}_{5}}{2}$-△H2 |
 g]
g]