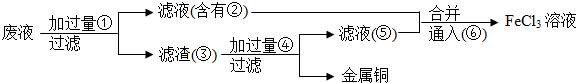
题目内容
16.过碳酸钠( Na2CO4)是一种很好的供氧剂,其与稀盐酸反应的化学方程式为:2Na2CO4+4HCl═4NaCl+2CO2+O2+2H2O.市售过碳酸钠一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下两种方案实施:方案一:[样品]$\stackrel{操作①}{→}$[样品m1g]$→_{操作②}^{稀盐酸}$[溶液]$\stackrel{操作③}{→}$[固体]$\stackrel{操作①}{→}$[固体m2
 g]
g](1)操作①和③的名称分别为称量、蒸发结晶
(2)上述操作中,使用到玻璃棒的有②③(填操作序号)
(3)请简述操作③的操作过程得到的溶液在蒸发皿中加热蒸发,用玻璃棒不断搅拌到大量晶体析出,停止加热靠余热蒸发剩余的水分得到氯化钠固体
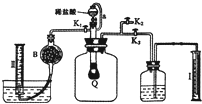
方案二:按如图安装好实验装置,Q为一塑料气袋,随意取适量样品于其中,打开分液漏斗活塞,将稀盐酸滴人气袋中至充分反应.
(4)为测定反应生成气体的总体积,滴稀盐酸前必须关闭K1、K2,打开K3(填“K1”、“K2”或“K3”).导管a的作用是平衡分液漏斗上下的压强使顺利流下.
(5)当上述反应停止后,使K1、K3处于关闭状态,K2处于打开状态,再缓缓打开Kl. B中装的固体试剂是碱石灰,为何要缓缓打开K1?让生成的二氧化碳能充分被b中碱石灰吸收,使量筒内收集到纯净的氧气.
(6)实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到了ymL气体,则样品中过碳酸钠的质量分数是$\frac{122y}{53x-37y}$.
分析 方案一:(1)样品称量可以得到样品质量为m1g,加入稀盐酸溶解后,过滤得到溶液为氯化钠溶液,蒸发浓缩结、冷却结晶、洗涤、干燥得到氯化钠,称量得到固体氯化钠的质量为m2g;
(2)溶解、蒸发结晶需要用到玻璃棒;
(3)操作③是从溶液中获得晶体;
(4)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积;为使分液漏斗内液体顺利流下,应是分液漏斗内外压强相等;
(5)用碱石灰吸收二氧化碳,量筒Ⅱ中排出液态的体积为氧气体积,气流速度太快,不利于二氧化碳吸收;
(6)根据生成氧气的体积计算过碳酸钠反应生成二氧化碳的体积,结合二氧化碳的总体积可以计算碳酸钠反应生成二氧化碳的体积,根据二氧化碳的可以起到过碳酸钠与碳酸钠的物质的量之比,进而计算过碳酸钠的质量分数.
解答 解:样品称量可以得到样品质量为m1g,加入稀盐酸溶解后,过滤得到溶液为氯化钠溶液,蒸发浓缩结、冷却结晶、洗涤、干燥得到氯化钠,称量得到固体氯化钠的质量为m2g.
(1)操作①为称量固体质量,操作③为结晶得到氯化钠固体,
故答案为:称量;蒸发结晶;
(2)固体溶解需要玻璃棒搅拌加速溶解,溶液中得到溶质固体需要在蒸发皿中加热蒸发结晶,过程中需要玻璃棒搅拌,受热均匀,上述操作中,使用到玻璃棒的有②③,
故答案为:②③;
(3)溶液中得到溶质固体的方法是加热蒸发结晶析出,具体操作为:得到的溶液在蒸发皿中加热蒸发,用玻璃棒不断搅拌到大量晶体析出,停止加热靠余热蒸发剩余的水分得到氯化钠固体,
故答案为:得到的溶液在蒸发皿中加热蒸发,用玻璃棒不断搅拌到大量晶体析出,停止加热靠余热蒸发剩余的水分得到氯化钠固体;
(4)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积,所以滴稀H2SO4前必须关闭K1、K2打开K3,为使分液漏斗内液体顺利流下,应是分液漏斗内外压强相等,所以导管a的作用是平衡分液漏斗上下的压强使顺利流下,
故答案为:K1、K2;K3; 平衡分液漏斗上下的压强使顺利流下;
(5)用碱石灰吸收二氧化碳,量筒Ⅱ中排出液态的体积为氧气体积,缓缓打开K1,让生成的二氧化碳能充分被b中碱石灰吸收,使量筒内收集到纯净的氧气,
故答案为:碱石灰;让生成的二氧化碳能充分被b中碱石灰吸收,使量筒内收集到纯净的氧气;
(6)量筒I中有xmL水,则CO2、O2的总体积为xmL,量筒Ⅱ中收集到了ymL气体,则O2总体积为y mL,则反应2Na2CO4+4HCl═4NaCl+2CO2+O2+2H2O,生成的二氧化碳为2y mL,碳酸钠反应生成二氧化碳为(x-y-2y)=(x-3y) mL,生成二氧化碳物质的量之比为2y:(x-3y),则Na2CO4与碳酸钠的物质的量之比为2y:(x-3y),故样品中过碳酸钠的质量分数是$\frac{2y×122}{2y×122+(x-3y)×106}$=$\frac{122y}{53x-37y}$,
故答案为:$\frac{122y}{53x-37y}$.
点评 本题考查了物质含量的实验测定方法,关键是理解测定原理,定量实验中尽可能减小误差,(6)中计算为易错点,注意测量气体的体积不一定是标况下,题目难度中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 分子式为C3H6Cl2的同分异构体有四种 | |
| B. | 分子式为C8H10的芳香烃有3个,分别为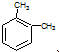 、 、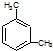 和 和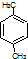 | |
| C. | 分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3 | |
| D. | 二氯甲烷有两种同分异构体 |
| A. | Ca2+:1s22s22p63s23p6 | B. | O:1s22s22p6 | ||
| C. | P:1s22s22p63s23p3 | D. | Br:1s22s22p63s23p63d104s24p5 |
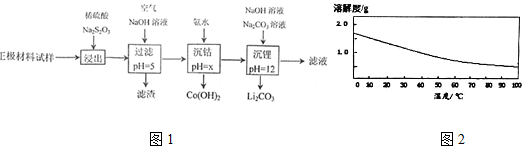
已知:
①Co(OH)2是两性氢氧化物.
②
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 |
| 开始沉淀的pH | 3.1 | 7.1 | 2.2 |
| 完全沉淀的pH | 4.7 | 9.7 | 3.7 |
(1)浸出过程中为加快浸出速率,可以采取的措施有充分搅拌、升高温度(写出两点).
(2)浸出过程中Na2S2O3被氧化为Na2SO4的化学方程式为8LiCoO2+11H2SO4+Na2S2O3=4Li2SO4+8CoSO4+Na2SO4+11H2O.该过程中可用盐酸代替H2SO4和Na2S2O3,但缺点是生成氯气,污染环境.
(3)滤渣的成分为Al(OH)3、Fe(OH)3,充入空气的目的是将Fe2+被氧化为Fe3+.
(4)沉钴过程中不使用NaOH溶液的原因是Co(OH)2是两性氢氧化物,能与NaOH溶液反应导致沉淀的质量减少.当溶液中c(Co2+)≤10-5mol•L-1时即认为沉淀完全,则需要控制x≥9(Ksp[Co(OH)2]=1.0×10-15).制得的Co(OH)2不宜在空气中长期放置,会被空气中的O2氧化成Co(OH)3,化学反应方程式为4Co(OH)2+O2+2H2O=4Co(OH)3.
(5)碳酸锂的溶解度随温度的变化如右图所示,则洗涤碳酸锂沉淀时应选热水(填“热水”或“冷水”).
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| C. | 锌摄入量过多,也会引起缺铁性贫血 | |
| D. | 为了防止龋齿,人人都适合使用含氟牙膏 |
(1)下列关于自行车金属部件的防腐措施 不正确的是D(填标号).
A.为车架、挡泥板、车后座、车座弹簧烤上一层漆
B.为链条涂上机油,为轴承涂上凡士林
C.对车把、车圈、车辐条进行电镀处理
D.把自行车存放在阴凉、潮湿的地方
(2)家庭中“钢精锅”是由铝合金做成的,它能长期使用的原因是
铝表面形成一层致密的氧化膜,阻止内部金属进一步被氧化.
(3)某合金和铁的有关性质如下表:
| 熔点/℃ | 密度/g.cm-3 | 硬度 | 导电性 | |
| 某合金 | 2500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1535 | 7.86 | 4.5 | 17 |
A.导线 B.门窗框 C.炉具 D.飞机外壳.