题目内容
3.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下(部分操作和条件略):Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.再经过一系列操作,分离得到产品.
(1)步骤Ⅰ中过滤所得滤渣主要成分为:SiO2,H2SO4溶解Al2O3的离子方程式为:Al2O3+6H+=2Al3++3H2O.
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O.
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
①根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀,
②当Al3+开始沉淀时,Fe3+的浓度约为:10-6.7 mol•L-1.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②步骤Ⅳ中加入MnSO4的目的是:除去过量的MnO4-;.
(5)步骤Ⅴ中“一系列操作”是蒸发浓缩、冷却结晶.
分析 (1)Al2O3、FeO•xFe2O3能与硫酸反应,而SiO2不与硫酸反应,硫酸溶解氧化铝生成硫酸铝和水;
(2)依据氧化还原反应电子守恒和原子守恒,结合元素化合价变化分析产物和反应物,据此书写离子方程式;
(3)①铁离子开始沉淀和沉淀完全的溶液pH为1.5~2.8,铝离子开始沉淀pH为3.4,亚铁离子开始沉淀的溶液pH大于铝离子完全沉淀pH,向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离;
②浓度为0.1mol•L-1的Fe3+开始沉淀时,溶液pH为1.5,所以Ksp[Fe(OH)3]=0.1×(10-14+1.5)3=1×10-38.5,当Al3+开始沉淀时,溶液pH为3.4,据此计算Fe3+的浓度;
(4)①向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水;
②MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去;
(5)从溶液中获得Al2(SO4)3•18H2O晶体,可以通过蒸发浓缩、冷却结晶的方法;
解答 解:(1)Al2O3、FeO•xFe2O3能与硫酸反应,而SiO2不与硫酸反应,步骤Ⅰ过滤得到沉淀的主要成分为:SiO2,硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;
故答案为:SiO2;Al2O3+6H+=2Al3++3H2O;
(2)高锰酸根离子在酸溶液中被还原为锰离子,亚铁离子被氧化为铁离子,反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,
故答案为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
(3)①铁离子开始沉淀和沉淀完全的溶液pH为1.5~2.8,铝离子开始沉淀pH为3.4,亚铁离子开始沉淀的溶液pH大于铝离子完全沉淀pH,向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离,步骤II的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀,
故答案为:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
②浓度为0.1mol•L-1的Fe3+开始沉淀时,溶液pH为1.5,所以Ksp[Fe(OH)3]=0.1×(10-14+1.5)3=1×10-38.5,当Al3+开始沉淀时,溶液pH为3.4,即溶液中氢氧根离子的浓度为1×10-14+3.4 mol•L-1=1×10-10.6 mol•L-1,所以Fe3+的浓度为$\frac{1×10{\;}^{-38.5}}{(1×10{\;}^{-10.6})^{3}}$=10-6.7 mol•L-1,
故答案为:10-6.7 mol•L-1;
(4)①向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水生成的氯气是黄绿色气体,能说明沉淀中存在MnO2,
故答案为:生成黄绿色气体;
②MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去,
故答案为:除去过量的MnO4-;
(5)从溶液中获得Al2(SO4)3•18H2O晶体,可以通过蒸发浓缩、冷却结晶的方法,
故答案为:蒸发浓缩、冷却结晶.
点评 本题考查实验制备方案,侧重考查学生对原理及操作的分析评价、对数据的分析运用、物质的分离提纯等,需要学生具备知识的基础,难度中等.

 金钥匙试卷系列答案
金钥匙试卷系列答案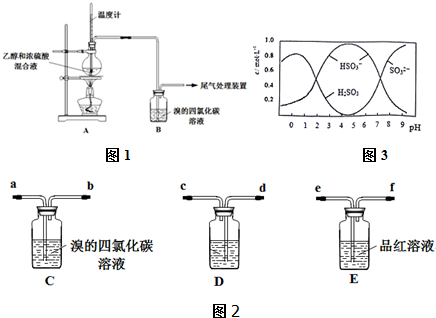
Ⅰ、已知:实验室制乙烯原理为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=═CH2↑+H2O,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用下列实验验证.(气密性已检验,部分夹持装置略如图1).
实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(2)分析,甲认为是C2H4,乙认为不能排除SO2的作用.
①根据甲的观点,使B中溶液褪色反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br;
②乙根据现象认为实验中产生的SO2和H2O,使B中有色物质反应褪色.
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色.
乙:用下列装置按一定顺序与A连接:(尾气处理装置略如图2)
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色.
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是NaOH溶液;乙设计的实验D中盛放的试剂是浓硫酸,装置连接顺序为(d)cabe(f).
b.能说明确实是SO2使E中溶液褪色的实验是加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2.
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是SO2+2H2O+Br2═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓或SO2+2H2O+Br2+Ba2+═4H++2Br-+BaSO4↓.由此可得出的干燥的SO2 不能使Br2 的四氯化碳溶液褪色
Ⅱ、葡萄酒中常用Na2S2O5做抗氧化剂.
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图3所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中c(SO32-)≤0.05mol•L-1.
| A. | 增大B的浓度,v(正)>v(逆) | |
| B. | 升高温度,平衡向逆反应方向移动,v(正)减小 | |
| C. | 压强增大一倍,平衡不移动,v (正)、v(逆)不变 | |
| D. | 增加A的量,平衡向正反应方向移动 |
| A. | 可用了达尔现象区分溶液与胶体 | |
| B. | 生石灰与水混合的过程只发生物理变化 | |
| C. | 明矾净水只发生了物理变化 | |
| D. | CuSO4•5H20 是一种混合物 |
| A. | 若1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA | |
| B. | 22.4LHCl中的分子数为NA | |
| C. | Na2O2与水充分作用生成0.1molO2时转移的电子数为0.2NA | |
| D. | 0.1mol铁与足量盐酸反应转移的电子数为0.3NA |