题目内容
15.实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应过程中能量(单位为kJ•mol-1)的变化: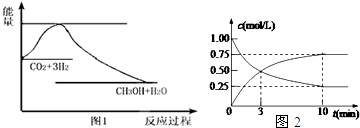
(1)关于该反应的下列说法中,正确的是C(填字母).
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示.
①从反应开始到平衡,CO2的平均反应速率v(CO2)=0.075mol/(L•min);
②下列措施中能使化学平衡向正反应方向移动的是BD (填字母).
A.升高温度 B.将CH3OH(g)及时液化抽出 C.选择高效催化剂 D.再充入l molCO2和4molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)→CO2(g)+2H2O(l)△H=-726.6kJ/mol.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极的电极反应式是:CH3OH-6e-+8OH-=CO32-+6H2O.
分析 (1)反应物总能量高于生成物总能量,反应为放热反应,正反应为气体物质的量减小的反应,则为熵减的反应;
(2)①由图2可知,CO2的浓度变化量为(1-0.25)mol/L=0.75mol/L,根据v=$\frac{△c}{△t}$计算v(CO2);
②A.升高温度平衡向吸热反应方向移动;
B.将CH3OH(g)及时液化抽出,生成物浓度减小,平衡正向移动;
C.选择高效催化剂,不影响平衡移动;
D.再充入l molCO2和4molH2,压强增大,平衡向气体体积减小的方向移动;
(3)计算1mol甲醇燃烧放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(4)碱性甲醇燃料电池为原电池,原电池负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水.
解答 解:反应物总能量高于生成物总能量,反应为放热反应,正反应为气体物质的量减小的反应,则为熵减的反应,即△H<0,△S<0,
故选:C;
(2)①由图2可知,CO2的浓度变化量为(1-0.25)mol/L=0.75mol/L,v(CO2)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),
故答案为:0.075mol/(L•min);
②A.正反应为放热反应,升高温度平衡逆向移动,故A错误;
B.将CH3OH(g)及时液化抽出,生成物浓度减小,平衡正向移动,故B正确;
C.选择高效催化剂,可以加快反应速率,但不影响平衡移动,故C错误;
D.再充入l molCO2和4molH2,压强增大,正反应为气体体积减小的反应,则平衡正向移动,故D正确,
故选:BD;
(3)16g 液态甲醇完全燃烧生成CO2和液态H2O时放出363.3kJ热量,则1mol甲醇燃烧放出的热量=363.3kJ×$\frac{1mol/L×32g/mol}{16g}$=726.6kJ,故热化学反应方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)→CO2(g)+2H2O(l)△H=-726.6kJ/mol,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)→CO2(g)+2H2O(l)△H=-726.6kJ/mol;
(4)碱性甲醇燃料电池为原电池,原电池负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水,负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
点评 本题考查化学平衡计算与影响因素、反应速率、热化学方程式、原电池等,属于拼合型题目,是对学生综合能力的考查,难度中等.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. | 1LCO2中含有3NA个原子 | |
| B. | 1molCl2含有1NA个原子 | |
| C. | 23g钠在足量的Cl2中反应,转移电子数NA个 | |
| D. | 欲配制1.00L1.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.再经过一系列操作,分离得到产品.
(1)步骤Ⅰ中过滤所得滤渣主要成分为:SiO2,H2SO4溶解Al2O3的离子方程式为:Al2O3+6H+=2Al3++3H2O.
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O.
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
①根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀,
②当Al3+开始沉淀时,Fe3+的浓度约为:10-6.7 mol•L-1.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②步骤Ⅳ中加入MnSO4的目的是:除去过量的MnO4-;.
(5)步骤Ⅴ中“一系列操作”是蒸发浓缩、冷却结晶.
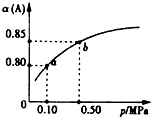 一定温度下,向容积为1L的密闭容器中加入0.5molA和0.25molB,发生反应:2A(g)+B(g)?2C(?),达到平衡时,放出热量Q1kJ.保持温度不变,A的平衡转化率(α)与体系总压强(p)的关系如图所示.则下列说法正确的是( )
一定温度下,向容积为1L的密闭容器中加入0.5molA和0.25molB,发生反应:2A(g)+B(g)?2C(?),达到平衡时,放出热量Q1kJ.保持温度不变,A的平衡转化率(α)与体系总压强(p)的关系如图所示.则下列说法正确的是( )| A. | 若容器内气体的密度保持不变,说明反应一定达到平衡状态 | |
| B. | 若在相同条件下,改为只加入0.5 mol C,则反应达到平衡反,放出热量Q1kJ | |
| C. | 平衡状态由a变到b时,则化学平衡常数K(a)=K(b) | |
| D. | 由图象可知,产物C一定是气体 |
| A. | 混合气体密度 | B. | 容器内气体的压强 | ||
| C. | 混合气体的平均相对分子质量 | D. | A的转化率 |
| A. | MgO固体(SiO2),加过量NaOH溶液充分反应,过滤、洗涤、干燥 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水溶解、蒸发、结晶、过滤、洗涤、干燥 | |
| D. | FeCl3溶液(CuCl2),过量铁粉,过滤 |

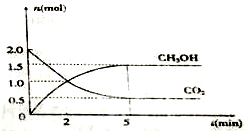 “低碳循环”引起了全世界的高度重视,减排CO2的一种方法是:
“低碳循环”引起了全世界的高度重视,减排CO2的一种方法是: