题目内容
铜和稀硝酸在常温常压下反应,开始时反应非常慢,但是随着反应的进行,反应速率不断地加大.某校合作学习小组的同学拟探究影响其速率的主要因素.
(1)甲同学认为是生成的Cu2+对该反应起催起作用,欲验证其假设是否正确,其实验方法是 .
(2)乙同学依据铜和硝酸是放热反应,拟研究温度升高是否为该反应速度率不断加大的主要原因,实验结果如下:
由此可得出的结论是: .
(3)丙同学查阅文献,得知稀硝酸与铜反应,还原产物起始也是NO2,NO2对该反应起催化作用.通过下列装验证.实验发现左侧3min后开始大量产生气泡,右侧40min内无明显变化.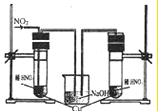
①氢氧化钠溶液的作用是 .
②该学生设计在左侧加的是2mol?L-1HNO3溶液,右侧加的是2.2mol?L-1硝酸.左侧浓度稍偏小,这样设计主要是考虑到 .
(4)丁同学与丙同学交流后,他将实验改进为:在试管中加入3mL2mol?L-1HNO3并放入铜片,然后加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡.由丁的实验可得出的结论是 .
(1)甲同学认为是生成的Cu2+对该反应起催起作用,欲验证其假设是否正确,其实验方法是
(2)乙同学依据铜和硝酸是放热反应,拟研究温度升高是否为该反应速度率不断加大的主要原因,实验结果如下:

由此可得出的结论是:
(3)丙同学查阅文献,得知稀硝酸与铜反应,还原产物起始也是NO2,NO2对该反应起催化作用.通过下列装验证.实验发现左侧3min后开始大量产生气泡,右侧40min内无明显变化.

①氢氧化钠溶液的作用是
②该学生设计在左侧加的是2mol?L-1HNO3溶液,右侧加的是2.2mol?L-1硝酸.左侧浓度稍偏小,这样设计主要是考虑到
(4)丁同学与丙同学交流后,他将实验改进为:在试管中加入3mL2mol?L-1HNO3并放入铜片,然后加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡.由丁的实验可得出的结论是
考点:探究影响化学反应速率的因素
专题:实验探究和数据处理题,化学反应速率专题
分析:(1)选取两支试管,一支加入含有铜离子的盐,另一支不加铜盐,然后比较反应速率,从而确定铜离子是否影响反应速率;
(2)根据图象确定温度对反应速率的影响;
(3)二氧化氮是有毒气体,不能直接排空,要用碱液进行尾气处理;二氧化氮易溶于水产生硝酸;
(4)根据加入的物质和反应速率之间的关系确定亚硝酸根离子的作用.
(2)根据图象确定温度对反应速率的影响;
(3)二氧化氮是有毒气体,不能直接排空,要用碱液进行尾气处理;二氧化氮易溶于水产生硝酸;
(4)根据加入的物质和反应速率之间的关系确定亚硝酸根离子的作用.
解答:
解:(1)为验证铜离子是否有催化作用,作比较实验,在一支试管中加入含有铜离子的盐,一支试管中不加铜盐,然后比较反应速率,根据反应速率大小确定假设是否正确,
故答案为:取两去试管分别加入同浓度的稀硝酸和相同的铜片,在其中一支中加入少量硫酸铜晶体,比较两者开始产生气泡的时间;
(2)根据图片知,80min内温度才上升了2℃,从而得知,温度升高不是其反应速率加快的原因,应该有其它因素,
故答案为:80min内温度只上升了2℃,说明温度变化不是主要原因;
(3)①,二氧化氮有毒不能直接排空,否则会污染空气,且二氧化氮溶于水生成硝酸和一氧化氮,溶液呈酸性,所以可以用碱性物质吸收二氧化氮,故答案为:吸收氮的氧化物,防止污染环境;
②二氧化氮溶于水生成硝酸,导致左侧试管中硝酸浓度增大,为了使两侧硝酸浓度相似,右侧试管中硝酸浓度应稍微大些,故答案为:左侧通入NO2时,一部分NO2与水反应会生成硝酸,使硝酸浓度变大;
(4)根据实验知,加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡,由此说明亚硝酸根离子有催化作用,据此还可以说明二氧化氮的催化机理可能是在反应中得电子生成NO2-起催化作用,
故答案为:NO2催化机理可能是在反应中得电子生成NO2-起催化作用(或答:NO2-对该反应也能起催化作用).
故答案为:取两去试管分别加入同浓度的稀硝酸和相同的铜片,在其中一支中加入少量硫酸铜晶体,比较两者开始产生气泡的时间;
(2)根据图片知,80min内温度才上升了2℃,从而得知,温度升高不是其反应速率加快的原因,应该有其它因素,
故答案为:80min内温度只上升了2℃,说明温度变化不是主要原因;
(3)①,二氧化氮有毒不能直接排空,否则会污染空气,且二氧化氮溶于水生成硝酸和一氧化氮,溶液呈酸性,所以可以用碱性物质吸收二氧化氮,故答案为:吸收氮的氧化物,防止污染环境;
②二氧化氮溶于水生成硝酸,导致左侧试管中硝酸浓度增大,为了使两侧硝酸浓度相似,右侧试管中硝酸浓度应稍微大些,故答案为:左侧通入NO2时,一部分NO2与水反应会生成硝酸,使硝酸浓度变大;
(4)根据实验知,加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡,由此说明亚硝酸根离子有催化作用,据此还可以说明二氧化氮的催化机理可能是在反应中得电子生成NO2-起催化作用,
故答案为:NO2催化机理可能是在反应中得电子生成NO2-起催化作用(或答:NO2-对该反应也能起催化作用).
点评:本题考查探究实验,解答这类题时要注意尽可能的把题中的能够影响化学反应的因素找出,然后再利用控制变量法来进行判断,最后得出答案,难度较大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
下列判断中,正确的是( )
| A、30%和H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
| B、SO2和CO2都属于酸性氧化物,Na2O和Al2O3都属于碱性氧化物 |
| C、在NH4Cl水溶液中,既存在水解平衡,又存在电离平衡 |
| D、O2在放电条件下生成O3属于化学变化,煤干馏得到焦炭属于物理变化 |
下列反应的离子方程式书写正确的是( )
| A、向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O |
| B、碳酸氢钠溶液中加入盐酸:CO32-+2 H+→H2O+CO2↑ |
| C、氨气通入稀硫酸溶液中:NH3+H+→NH4+ |
| D、Fe2(SO4)3的酸性溶液中通入足量硫化氢:Fe3++H2S→Fe2++S↓+2H+ |
相同状况下,下列气体所占体积最大的是( )
| A、80g SO3 |
| B、3g H2 |
| C、16g O2 |
| D、34g H2S |
已知丙基共有两种结构,由此可判断C4H8O的醛应有( )种.
| A、1 | B、2 | C、3 | D、4 |
反应A+B═C+D,8g A和12g B恰好完全反应,生成C和9g D,则生成C的质量为( )
| A、9g | B、10g |
| C、11g | D、12g |
下列离子方程式不正确的是( )
| A、碳酸钡与盐酸反应:BaCO3+2H+═Ba2++CO2↑+H2O |
| B、金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| C、钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
| D、NaHCO3溶液与NaOH溶液混合:HCO3-+OH-═CO32-+H2O |
