题目内容
下列反应的离子方程式书写正确的是( )
| A、向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O |
| B、碳酸氢钠溶液中加入盐酸:CO32-+2 H+→H2O+CO2↑ |
| C、氨气通入稀硫酸溶液中:NH3+H+→NH4+ |
| D、Fe2(SO4)3的酸性溶液中通入足量硫化氢:Fe3++H2S→Fe2++S↓+2H+ |
考点:离子方程式的书写
专题:离子反应专题
分析:A、碳酸氢钙和氢氧化钙反应生成碳酸钙沉淀和水;
B、碳酸氢根离子是弱酸阴离子不能拆成离子;
C、氨气和氢离子反应生成铵根离子;
D、选项中离子方程式的电荷不守恒.
B、碳酸氢根离子是弱酸阴离子不能拆成离子;
C、氨气和氢离子反应生成铵根离子;
D、选项中离子方程式的电荷不守恒.
解答:
解:A、向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液反应的离子方程式:Ca2++HCO3-+OH-═CaCO3↓+H2O,故A正确;
B、碳酸氢钠溶液中加入盐酸反应的离子方程式:HCO3-+H+=H2O+CO2↑,故B错误;
C、氨气通入稀硫酸溶液中反应的离子方程式为:NH3+H+=NH4+,故C正确;
D、Fe2(SO4)3的酸性溶液中通入足量硫化氢,铁离子氧化硫化氢为单质硫,反应的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,故D错误;
故选AC.
B、碳酸氢钠溶液中加入盐酸反应的离子方程式:HCO3-+H+=H2O+CO2↑,故B错误;
C、氨气通入稀硫酸溶液中反应的离子方程式为:NH3+H+=NH4+,故C正确;
D、Fe2(SO4)3的酸性溶液中通入足量硫化氢,铁离子氧化硫化氢为单质硫,反应的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,故D错误;
故选AC.
点评:本题考查了离子方程式书写方法和注意问题,反应实质、弱离子书写、离子方程式的电荷守恒判断是解题关键,题目难度中等.

练习册系列答案
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
钛(Ti)被称为“生物金属”,由Ti0Ρ制取Ti的主要反应:
①Ti02+2Cl2+2C
TiCl4+2CO
②TICl4+2Mg
2MgCl2+Ti
下列说法不正确的是( )
①Ti02+2Cl2+2C
| ||
②TICl4+2Mg
| ||
下列说法不正确的是( )
| A、反应①②都是氧化还原反应 |
| B、反应②是置换反应 |
| C、反应①中Ti02:是氧化剂 |
| D、反应②中每生成1mol Ti转移4 mol电子 |
下列说法正确的是( )
| A、将浓度为0.1mol?L-1 HF溶液加水不断稀释过程中,c( H+) 和c ( OH-)都会减小 |
| B、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的PH.若PH>7,则H2A是弱酸;若PH<7,则H2A是强酸 |
| C、将SO2通入一定量KOH溶液,所得溶液呈中性,该溶液中一定含KHSO3 |
| D、用0.200mol?L-1 NaOH标准溶液滴定浓度均为0.1mol?L-1 的HCl与CH3COOH的混合液,至中性时,溶液中的酸恰好被完全中和 |
下列离子方程式与所述事实相符且正确的是( )
| A、向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO4-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4 |
| B、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3═FeO42-+3Cl-+H2O+H+ |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO |
| D、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3++OH-═CaCO3↓+H2O |
下列物质都能导电,其中属于电解质的是( )
| A、稀盐酸 | B、熔融的NaCl |
| C、铜丝 | D、NaOH溶液 |
不属于氧化还原反应的是( )
A、8Al+3Fe3O4
| ||||
B、2Mg+CO2
| ||||
C、N2+3H2
| ||||
D、SiO2+CaO
|
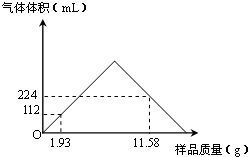 含钡化合物在实验室和工业生产中都有广泛的用途.
含钡化合物在实验室和工业生产中都有广泛的用途.