题目内容
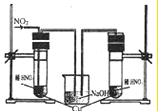
资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃).

(1)若在烧瓶放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,在洗气瓶中加入1mol/L NaOH溶液的体积V≥ mL,量气管的适宜规格是 (选填:200,400,500)mL.
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则发生反应的化学方程式为:
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到VmL气体,则有:
= .
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,
= (用含字母的代数式表示).

(1)若在烧瓶放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,在洗气瓶中加入1mol/L NaOH溶液的体积V≥
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则发生反应的化学方程式为:
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到VmL气体,则有:
| a |
| 65 |
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,
| n(H2) |
| n(SO2) |
考点:性质实验方案的设计,化学方程式的有关计算
专题:计算题,化学实验基本操作
分析:(1)根据锌的质量计算生成气体的体积,从而确定量气管的适宜规格;
(2)根据氢氧化钠的性质分析增重的原因,并写出相应的化学反应方程式;
(3)根据氧化还原反应的特点分析;
(4)根据氢氧化钠洗气瓶增重的量求出反应的硫酸的物质的量,硫酸总量减去生成二氧化硫需要的硫酸的量即为生成氢气的硫酸的量,继而求出生成气体的物质的量.
(2)根据氢氧化钠的性质分析增重的原因,并写出相应的化学反应方程式;
(3)根据氧化还原反应的特点分析;
(4)根据氢氧化钠洗气瓶增重的量求出反应的硫酸的物质的量,硫酸总量减去生成二氧化硫需要的硫酸的量即为生成氢气的硫酸的量,继而求出生成气体的物质的量.
解答:
解:(1)为保证实验结论的可靠,在洗气瓶中加入1mol/L NaOH溶液除去二氧化硫,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
1 1
0.02mol
SO2+NaOH=NaHSO3;
0.02mol 0.02mol
需要1mol/L NaOH溶液的体积最少为
=0.02L,即V≥20ml;
Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.448L
0.448L=448mL,故选500ml的量筒,
故答案为:20;500;
(2)氢氧化钠是碱,能吸收酸性气体,氢氧化钠洗气瓶增重说明有酸性气体生成,当锌和硫酸反应时,锌作还原剂,硫酸作氧化剂,被还原为二氧化硫,发生反应的化学方程式为:
Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O,
故答案为:Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O;
(3)根据氧化还原反应中得失电子数相等列出式子.若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到Vml气体,
则依据化学反应方程式:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,
由电子守恒列式计算有:ag/65g?mol-1×2=bg/64g?mol-1×2+V ml/22400ml?mol-1×2,
得到
=
+
,故答案为:
+
;
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
2mol 1mol
mol
mol
生成二氧化硫需要的硫酸为
mol;
Zn+H2SO4=ZnSO4+H2↑
1mol 1mol
(CV-
)mol (CV-
)mol
=
=
,
故答案为:
.
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
1 1
| 1.30g |
| 65g/mol |
SO2+NaOH=NaHSO3;
0.02mol 0.02mol
需要1mol/L NaOH溶液的体积最少为
| 0.02mol |
| 1mol/L |
Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
| 1.30g |
| 65g/mol |
0.448L=448mL,故选500ml的量筒,
故答案为:20;500;
(2)氢氧化钠是碱,能吸收酸性气体,氢氧化钠洗气瓶增重说明有酸性气体生成,当锌和硫酸反应时,锌作还原剂,硫酸作氧化剂,被还原为二氧化硫,发生反应的化学方程式为:
Zn+2H2SO4(浓)
| ||
故答案为:Zn+2H2SO4(浓)
| ||
(3)根据氧化还原反应中得失电子数相等列出式子.若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到Vml气体,
则依据化学反应方程式:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,
由电子守恒列式计算有:ag/65g?mol-1×2=bg/64g?mol-1×2+V ml/22400ml?mol-1×2,
得到
| a |
| 65 |
| b |
| 64 |
| V |
| 22400 |
| b |
| 64 |
| V |
| 22400 |
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
2mol 1mol
| m |
| 32 |
| m |
| 64 |
生成二氧化硫需要的硫酸为
| m |
| 32 |
Zn+H2SO4=ZnSO4+H2↑
1mol 1mol
(CV-
| m |
| 32 |
| m |
| 32 |
| n(H2) |
| n(SO2) |
CV-
| ||
|
| 64CV-2m |
| m |
故答案为:
| 64CV-2m |
| m |
点评:本题考查了排气量气装置,要注意的是锌和硫酸的反应,硫酸浓度不同时,锌和硫酸反应的生成物不同,表现氧化性的元素也不同,题目难度中等.

练习册系列答案
相关题目
下列物质都能导电,其中属于电解质的是( )
| A、稀盐酸 | B、熔融的NaCl |
| C、铜丝 | D、NaOH溶液 |
亚硝酸(HNO2)的下列性质中,不可以证明它是弱电解质的是( )
| A、100mL l mol/L的亚硝酸溶液恰好与100mL l mol/L的NaOH溶液完全反应 |
| B、0.1mol/L的亚硝酸溶液的PH约为2 |
| C、同浓度的亚硝酸比盐酸导电能力弱 |
| D、10mL同浓度的亚硝酸与盐酸,与等质量锌粉反应,盐酸更快 |
下列气体通入水中,不能形成电解质溶液的是( )
| A、NH3 |
| B、O2 |
| C、HBr |
| D、HCl |
在无土栽培中,需配制一定量含50mol NH4Cl、6mol KCl和24mol K2SO4的营养液.若用KCl、NH4Cl、(NH4)2SO4为原料来配制此营养液,三者的物质的量依次是( )mol.
| A、2、54、24 |
| B、54、2、24 |
| C、32、50、12 |
| D、16、50、24 |
用NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A、常温常压下,22.4L氢气中含有的氢分子数为NA |
| B、24gMg变为Mg2+时失去的电子数为2 NA |
| C、32g臭氧分子中含有的氧原子数为2 NA |
| D、1L1mol/LCaCl2溶液中含有氯离子数为2 NA |