题目内容
10.下列有关物质的性质和该性质的应用均正确的是( )| A. | SO2具有氧化性,用来杀菌消毒 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 碳酸氢钠热稳定性弱,用作焙制糕点的发酵粉 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
分析 A.二氧化硫与水反应生成亚硫酸,亚硫酸能够使蛋白质变性;
B.氢氟酸为弱酸;
C.碳酸氢钠受热分解生成二氧化碳和水、碳酸钠;
D.铜与浓硝酸发生氧化还原反应,被浓硝酸溶解,铝与冷的浓硝酸发生钝化,形成致密氧化膜.
解答 解:A.二氧化硫与水反应生成亚硫酸,亚硫酸能够使蛋白质变性,所以二氧化硫可以用于杀菌消毒,故A错误;
B.氢氟酸为弱酸,故B错误;
C.碳酸氢钠性质不稳定,受热分解生成二氧化碳和水、碳酸钠,所以可用作焙制糕点的发酵粉,故C正确;
D.铜与浓硝酸发生氧化还原反应,被浓硝酸溶解,铝与冷的浓硝酸发生钝化,形成致密氧化膜,所以不能用铜罐储运浓硝酸,可以用铝罐储运,故D错误;
故选:C.
点评 本题考查了物质的性质和用途,明确二氧化硫、氢氟酸、碳酸氢钠、浓硝酸的性质是解题关键,题目难度不大,注意对基础知识的积累.

练习册系列答案
相关题目
20.两种气态烃组成的混合气体0.1mol,完全燃烧得0.18mol CO2和3.6g H2O,下列关于该混合气体的说法正确的是( )
| A. | 一定有乙烯 | B. | 一定没有乙烯 | C. | 一定有甲烷 | D. | 一定有乙烷 |
1.反应4NH3(g)+5O2(g)$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O在2L的密闭容器中进行,30s后NO的物质的量增加了0.30mol.下列说法正确的是( )
| A. | 容器中NH3的物质的量一定增加了0.30mol | |
| B. | 容器中H2O(g)的物质的量至少为0.45mol | |
| C. | NH3的平均反应速率为0.010mol/(L•s) | |
| D. | NH3、O2、NO、H2O的物质的量之比一定为4:5:4:6 |
5.下列有机物名称正确的是( )
①2-乙基戊烷?②1,2-二氯丁烷?③2,2-二甲基-4-己醇 ④3,4-二甲基戊烷 ⑤二溴乙烷 ⑥1-甲基丙醇
⑦2-甲基-3-戊炔 ⑧2-甲基-1,3-丁二烯.
①2-乙基戊烷?②1,2-二氯丁烷?③2,2-二甲基-4-己醇 ④3,4-二甲基戊烷 ⑤二溴乙烷 ⑥1-甲基丙醇
⑦2-甲基-3-戊炔 ⑧2-甲基-1,3-丁二烯.
| A. | ①⑤⑥ | B. | ②③④ | C. | ②⑧ | D. | ③⑥⑦ |
15.下列各项中两个反应不属于同一反应类型的是( )
| A. | 由苯与氢气生成环己烷;由乙烯制一氯乙烷 | |
| B. | 乙醇与乙酸制取乙酸乙酯;油脂的皂化反应 | |
| C. | 乙烯与氧气制环氧乙烷;乙醇制乙醛 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色;丙烯酸使溴水褪色 |
2.对乙烯基苯甲酸在医药中间体合成中有着广泛的用途,可用化合物M反应合成:
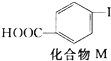 +CH2═CH2$\stackrel{一定条件}{→}$
+CH2═CH2$\stackrel{一定条件}{→}$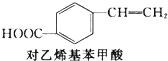 +HI
+HI
下列关于化合物M和对乙烯基苯甲酸的说法正确的是( )
 +CH2═CH2$\stackrel{一定条件}{→}$
+CH2═CH2$\stackrel{一定条件}{→}$ +HI
+HI下列关于化合物M和对乙烯基苯甲酸的说法正确的是( )
| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸既属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和加成反应 |
20.根据下列实验操作和观察到的现象,得出的结论一定是正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | SO2通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| B | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变成黄色 | 氧化性:H2O2>Fe2+ |
| C | 将溴乙烷与NaOH的乙醇溶液共热,将生成的气体直接通入KMnO4酸性溶液中 | KMnO4酸性溶液褪色 | 乙烯使KMnO4酸性溶液褪色 |
| D | 向a、b两支盛有KI3溶液的试管中分别加入淀粉溶液、硝酸银溶液. | a试管中溶液变蓝 b试管中产生黄色沉淀 | KI3溶液中存在平衡I3--?I2+I- |
| A. | A | B. | B | C. | C | D. | D |

 .
. .
. .
.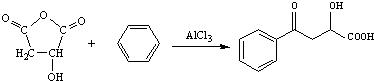 .
.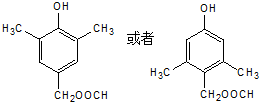 .
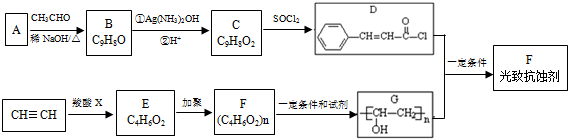
.
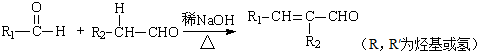
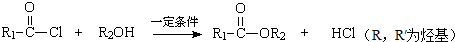
 .
. .
. .
.