题目内容
4.同周期的三种主族元素X、Y、Z,它们的最高价氧化物对应的水化物分别是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X<Y<Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序增强 | |
| D. | 元素的最低负价的绝对值按X、Y、Z顺序增大 |
分析 同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z,
A.同周期自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
B.同周期随原子序数的增大,非金属性增强;
C.非金属性越强,氢化物越稳定;
D.最低负化合价=最高正化合价-8.
解答 解:同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z,
A.同周期自左而右非金属性增强,故非金属性X>Y>Z,非金属性越强,最高价含氧酸的酸性越强,故含氧酸的酸性强弱为:H3ZO4<H2YO4<HXO4,故A错误;
B.非金属性从左向右增强,则非金属性为X>Y>Z,故B错误;
C.非金属性X>Y>Z,非金属性越强,氢化物越稳定,故氢化物稳定性按X、Y、Z顺序由强到弱,故C错误;
D.X、Y、Z最低负化合价分别为-1、-2、-3,元素的最低负价的绝对值按X、Y、Z顺序增大,故D正确;
故选D.
点评 本题考查原子结构与元素周期律的应用,为高频考点,侧重对元素周期律、同周期元素性质递变规律的考查,试题培养了学生的分析、理解能力及灵活应用能力,题目难度中等.

练习册系列答案
相关题目
12.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1 NaHCO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1CH3COOH溶液等体积混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 0.10mol•L-1CH3COONa溶液中通入HCl至中性,所得溶液中:c(Na+)>c(CH3COOH)=c(Cl-) |
12.如表为长式周期表的一部分,其中的编号代表对应的元素.
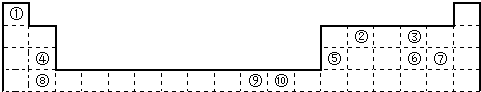
请回答下列问题:
(1)用元素符号表示⑥所在周期(除稀有气体元素外)电负性最大的元素是Cl.
(2)已知元素周期表可按电子排布分为s区、p区等,则⑩元素在ds区.
(3)写出⑩的常见阳离子的最外层电子排布3s23p63d10.
(4)元素⑦基态原子中能量最高的是3p电子,其电子云形状为哑铃形.
(5)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是BD.
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp2-s的σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(6)如表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
请回答:表中的金属元素是BEF(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是B元素的np轨道上的电子半充满,自身更稳定,所以第一电离能比A、C大.

请回答下列问题:
(1)用元素符号表示⑥所在周期(除稀有气体元素外)电负性最大的元素是Cl.
(2)已知元素周期表可按电子排布分为s区、p区等,则⑩元素在ds区.
(3)写出⑩的常见阳离子的最外层电子排布3s23p63d10.
(4)元素⑦基态原子中能量最高的是3p电子,其电子云形状为哑铃形.
(5)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是BD.
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp2-s的σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(6)如表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
19.化学与生产、生活密切相关,下列对物质的用途、解释均正确的是( )
| 选项 | 物质 | 说法 | 解释 |
| A | 氯化镁 | 用惰性电极电解MgCl2溶液可冶炼Mg | Mg2+在阴极得电子生成Mg |
| B | 氧化铝 | 制作耐高温材料 | Al2O3熔点很高 |
| C | 硫酸钡 | 医学上用做钡餐 | Ba2+无毒 |
| D | 明矾 | 作消毒剂 | 明矾水解产生具有吸附性的胶体粒子 |
| A. | A | B. | B | C. | C | D. | D |
9.下列叙述正确的是( )
| A. | 副族元素没有非金属元素 | |
| B. | 除短周期外,其他周期均为18种元素 | |
| C. | 同周期相邻的第ⅡA族和第ⅢA族的元素,原子序数只相差1 | |
| D. | 核外电子排布相同的微粒化学性质也相同 |
16.下列叙述中,正确的是( )
| A. | 在船舶的外壳装上铜块可防止其发生电化学腐蚀 | |
| B. | MnO2可加快H2O2的分解速率是因为降低了该反应的活化能 | |
| C. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 | |
| D. | 用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
13.下列有机反应的化学方程式书写正确是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH2Cl2+H2 | |
| B. | 2 +Br2$\stackrel{FeBr_{3}}{→}$2 +Br2$\stackrel{FeBr_{3}}{→}$2 | |
| C. | CH3CH2OH+O2$→_{△}^{Cu}$CH3CHO+H2O | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{H_{2}SO_{4}(浓)}$CH3COOCH2CH3+H2O |
14.NA表示阿伙加德罗常数的值.下列判断正确的是( )
| A. | 1 mol 氢氧根和1 mol 羟基中含有的质子数均为 9 NA | |
| B. | 1mol Cl2参加反应,转移电子数一定为2NA | |
| C. | 标准状况下,2.24 L氯仿(CHCl3)中含有C-Cl数目为0.3NA | |
| D. | 0.5 mol O3与11.2 LO2所含的分子数一定相等 |