题目内容
6. 如图所示,将 4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态 A 时,测得气体总物质的量为 4.2mol.若SO2、O2、SO3的起始物质的量分别用 a、b、c表示,回答下列问题:
如图所示,将 4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态 A 时,测得气体总物质的量为 4.2mol.若SO2、O2、SO3的起始物质的量分别用 a、b、c表示,回答下列问题:(1)在达到平衡状态A的容器中通入少量0.1mol O2,体系中SO2的体积分数减小(填“增大”或“减小”或“不变”),若要使SO2的体积分数再变到与平衡状态A 相同,可向容器中再加入SO2:0.2mol
(2)若起始时 a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态 A 相同,则起始时 c的取值为c≥0.
(3)若向原平衡体系中再加入SO3气体a mol,保持压强不变,达到平衡后SO2气体的物质的量为0.4+0.1amol.
分析 (1)恒温恒压下,通入少量0.1mol O2能使平衡正向移动并能提高SO2转化率,导致体系中SO2的体积分数减小,若要使SO2的体积分数再变至与原平衡状态A相同,根据恒温恒压下,只有反应物成比例就等效分析判断;
(2)若起始时a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态A相同,为等效平衡,恒温恒压下,按化学计量数完全转化到左边满足n(SO2):n(O2)=2:1;
(3)若向原平衡体系中再加入SO3气体a mol,相当于加入SO2a mol,O20.5a mol,保持压强不变,则与原平衡成比例等效,根据平衡状态 A 时计算剩余二氧化硫的量结合成比例等效确定达到新平衡后SO2气体的物质的量.
解答 解:(1)在达到平衡状态A的容器中再通入少量0.1mol O2,瞬间增大氧气的浓度,能使平衡正向移动并能提高SO2转化率,导致体系中SO2的体积分数减小,若要使SO2的体积分数再变至与原平衡状态A相同,则根据恒温恒压下,只有反应物成比例就等效,所以可再加入0.2molSO2;
故答案为:减小;0.2;
(2)若起始时a=1.2mol,b=0.6mol,二者物质的量之比等于起始时加入的2mol SO2和1mol O2的物质的量之比,而三氧化硫转化得到的SO2与O2d的物质的量之比也是2:1,则c≥0按化学计量数完全转化到左边满足n(SO2):n(O2)=2:1,建立的平衡一定为等效平衡,
故答案为:c≥0;
(3)设原平衡中反应的氧气为xmol,则:
2SO2(g)+O2(g)?2SO3(g)
起始(mol):4 2 0
变化(mol):2x x 2x
平衡(mol):4-2x 2-x 2x
则(4-2x)+(2-x)+2x=4.2,
解得x=1.8,故原平衡时SO2为0.4mol,
若向原平衡体系中再加入SO3气体a mol,相当于加入SO2a mol,O20.5a mol,保持压强不变,则与原平衡成比例等效,所以达到平衡后SO2气体的物质的量为(0.4+0.1a)mol,
故答案为:0.4+0.1a.
点评 本题考查化学平衡计算,涉及等效平衡问题,关键是理解掌握等效平衡规律,难度中等.

| A. | 铁遇冷浓硝酸表面被钝化,可保护内部不被腐蚀 | |
| B. | 船底镶嵌锌块,锌做负极,以防止船体被腐蚀 | |
| C. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| D. | 电解精炼铜时以纯铜作阴极,粗铜做阳极 |
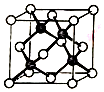 冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或圆心,实心球所示原子位于立方体内)类似.下列有关冰晶胞说法合理的是( )
冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或圆心,实心球所示原子位于立方体内)类似.下列有关冰晶胞说法合理的是( )| A. | 冰晶胞内水分子间以共价键结合 | |
| B. | 晶体冰与金刚石晶体硬度都很大 | |
| C. | 冰分子间的氢键无方向性和饱和性 | |
| D. | 氢键存在导致冰晶胞与金刚石晶胞排列方式类似 |
| A. | 氯气和二氧化硫均可做漂白剂,若同时使用它们漂白-湿润物质,漂白效果会更好 | |
| B. | 为消除碘缺乏病,卫生部规定食盐必须加碘,其中碘以单质形式存在 | |
| C. | 工业酒精不能勾兑美酒,因其中含有甲醇,饮后会造成人的双目终生失明 | |
| D. | 淀粉、纤维素和油脂都属于天然高分子化合物 |
| A. | 石灰石与稀盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ | |
| C. | 氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓ | |
| D. | 稀硝酸溶液与铜反应:Cu+4H++NO3-=Cu2++2H2O+NO↑ |

| A. | 铜棒为负极 | B. | 锌棒质量减轻 | ||
| C. | 溶液中阳离子向锌棒移动 | D. | 电子从铜棒经外电路流向锌棒 |
| A. | 放电时Cl-由负极向正极迁移 | |
| B. | 正极反应式为:AgCl+e-=Ag+Cl- | |
| C. | Mg作电池负极,发生氧化反应 | |
| D. | 当负极质量减轻4.8g,电路中通过0.4mol电子 |