题目内容
12.${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )| A. | ${\;}_{\;}^{16}$O2与${\;}_{\;}^{18}$O2是氧元素的两种核素 | |
| B. | 标准状况下,1.12L${\;}_{\;}^{16}$O2和1.12L${\;}_{\;}^{18}$O2均含有0.1NA个氧原子 | |
| C. | 通过化学变化可以实现${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O之间的相互转化 | |
| D. | ${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O核外电子排布方式不同 |
分析 A.核素是指具有一定数目质子和一定数目中子的一种原子;
B.1.12 L标准状况下O2的物质的量为0.05 mol;
C.16O与18O间的相互转化是核变化;
D.核外电子排布方式取决于核素核外电子数和质子数.
解答 解:A.${\;}_{\;}^{16}$O2与${\;}_{\;}^{18}$O2是单质,不是原子,故A错误;
B.1.12 L标准状况下O2的物质的量为0.05 mol,含有氧原子数为0.1NA,故B正确;
C.16O与18O间的相互转化是核变化,不是化学变化,故C错误;
D.核外电子排布方式取决于核素核外电子数和质子数,二者相同则核外电子排布方式相同,故D错误.
故选B.
点评 本题主要考查的是核素的概念以及化学变化等,难度不大,明确氧元素的两种核素间的关系(质子数相同,中子数不同)是解题关键.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
3. 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是
A.B.( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是A.B.( )
| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点排序:Y>T>R | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 单质氧化性:Y>R>T |
20.在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和 Pb2+,则与1mol Cr3+反应所需PbO2的物质的量为( )
| A. | 1.2 mol | B. | 1.5mol | C. | 3.0 mol | D. | 2.0 mol |
17.下列叙述正确的是( )
| A. | 在氧化还原反应中,失去电子的物质所含元素化合价降低 | |
| B. | 在一个氧化还原反应中,氧化剂和还原剂不可能是同一物质 | |
| C. | 氧化还原反应的本质是电子的转移(得失或偏移) | |
| D. | 在氧化还原反应中所有元素的化合价一定都发生变化 |
1.据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:HC≡C-C≡C-C≡C-C≡C-C≡N.对该物质判断正确的是( )
| A. | 不能使溴的四氯化碳溶液褪色 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 不能发生加成反应 | D. | 属于高分子化合物 |
2.胡椒酚是植物挥发油中的一种成分.关于胡椒酚(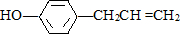 )的下列说法中正确的是( )
)的下列说法中正确的是( )
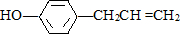 )的下列说法中正确的是( )
)的下列说法中正确的是( )| A. | 该化合物属于芳香烃 | |
| B. | 分子中至少有7个碳原子处于同一个平面 | |
| C. | 它的部分同分异构体能与碳酸氢钠溶液反应产生气体 | |
| D. | 1mol该化合物最多可与2molBr2发生反应 |
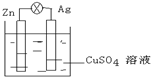 (1)在如图的银锌原电池中,银为正极,电极上发生的是还原反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu.锌片上观察到的现象为锌片溶解,电极反应式为Zn-2e-═Zn2+.
(1)在如图的银锌原电池中,银为正极,电极上发生的是还原反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu.锌片上观察到的现象为锌片溶解,电极反应式为Zn-2e-═Zn2+.