题目内容
中国气象局的数据显示,2013年全国平均雾霾天数为52年来之最.形成雾霾的主要成份为:生产生活中排放的废气、汽车尾气及扬尘等.
(1)用CH4可以消除汽车尾气中氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(1)△H=-955kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 .
(2)己知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-4lkJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0mol H2O(g),在2min时达到平衡,测得放出了32.8kJ热量,则2min内用H2表示的平均反应速率为 .由此可知在该温度下反应CO(g)+H2O(g)?CO2(g)+H2(g)的化学平衡常数为 .相同条件下,向同一密闭容器中充入1.0mol CO2和1.0molH2反应达到平衡后,吸收的热量为 kJ.
(1)用CH4可以消除汽车尾气中氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(1)△H=-955kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式
(2)己知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-4lkJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0mol H2O(g),在2min时达到平衡,测得放出了32.8kJ热量,则2min内用H2表示的平均反应速率为
考点:用盖斯定律进行有关反应热的计算,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题
分析:(1)现根据题意写出化学方程式,再根据“加减法”求算此反应的焓变;
(2)反应放出的热量与反应物消耗的物质的量成正比,由此可求得各组分的物质的量的变化及平衡时的浓度,代入化学反应速率公式和平衡常数表达式即可求出,反应吸收的热量由“等效平衡”原理求算.
(2)反应放出的热量与反应物消耗的物质的量成正比,由此可求得各组分的物质的量的变化及平衡时的浓度,代入化学反应速率公式和平衡常数表达式即可求出,反应吸收的热量由“等效平衡”原理求算.
解答:
解:(1)首先对已知两个热化学方程式编号:①CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-955kJ?mol-1
②2NO2(g)═N2O4(g)△H=-56.9kJ?mol-1,
所求热化学方程式为③CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)△H,利用“加减法”可知③=①-②,
所以△H=(-955kJ?mol-1 )-(-56.9kJ?mol-1)=-898.1 kJ?mol-1,
故答案为:CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)△H=-898.1 kJ?mol-1;
(2)反应达到平衡时△n(CO)=1mol×
=0.8mol,由此可求得各组分的数据如下所示:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始:2mol 2mol 0 0
变化:0.8mol 0.8mol 0.8mol 0.8mol
平衡:1.2mol 1.2mol 0.8mol 0.8mol
平衡浓度:0.6mol/L 0.6mol/L 0.4mol/L 0.4mol/L
所以v(H2)=
=0.2mol/(L?min);此反应的平衡常数K=
=
=
,
恒温恒容条件下,向同一密闭容器中充入1.0mol CO2和1.0mol H2反应所达到的平衡与充入1.0mol CO和1.0mol H2O反应所达到的平衡为等效平衡,前者达到平衡时吸收的热量与后者达到平衡所放出的热量之和等于41kJ,所以前者达到平衡时吸收的热量等于41kJ-
×32.8kJ=24.6kJ,
故答案为:0.2mol?L-1?min-1;
;24.6.
②2NO2(g)═N2O4(g)△H=-56.9kJ?mol-1,
所求热化学方程式为③CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)△H,利用“加减法”可知③=①-②,
所以△H=(-955kJ?mol-1 )-(-56.9kJ?mol-1)=-898.1 kJ?mol-1,
故答案为:CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)△H=-898.1 kJ?mol-1;
(2)反应达到平衡时△n(CO)=1mol×
| 32.8 |
| 41 |
CO(g)+H2O(g)?CO2(g)+H2(g)
开始:2mol 2mol 0 0
变化:0.8mol 0.8mol 0.8mol 0.8mol
平衡:1.2mol 1.2mol 0.8mol 0.8mol
平衡浓度:0.6mol/L 0.6mol/L 0.4mol/L 0.4mol/L
所以v(H2)=
| 0.4mol/L |
| 2min |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 0.4mol/L×0.4mol/L |
| 0.6mol/L×0.6mol/L |
| 4 |
| 9 |
恒温恒容条件下,向同一密闭容器中充入1.0mol CO2和1.0mol H2反应所达到的平衡与充入1.0mol CO和1.0mol H2O反应所达到的平衡为等效平衡,前者达到平衡时吸收的热量与后者达到平衡所放出的热量之和等于41kJ,所以前者达到平衡时吸收的热量等于41kJ-
| 1 |
| 2 |
故答案为:0.2mol?L-1?min-1;
| 4 |
| 9 |
点评:本题考查全面,热化学方程式书写要掌握好“加减法”求焓变的方法,书写时注意物质的状态和计算结果的准确性,对于化学反应速率和平衡常数的计算注意利用“三段法”理清各组分的量的大小.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
在“粗盐提纯”的实验中,蒸发时正确的操作是:( )
| A、把浑浊的液体倒入蒸发皿内加热 | ||
| B、开始析出晶体后用玻璃棒搅拌 | ||
C、蒸发时液体不超过蒸发皿容积的
| ||
| D、蒸发皿中出现大量固体时即停止加热 |

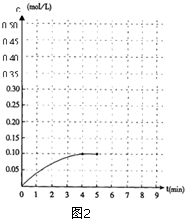 内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2 (g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图2:
内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2 (g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图2: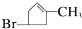 .化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
.化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.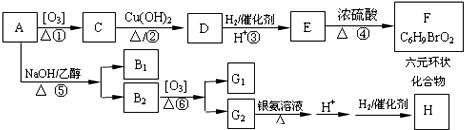
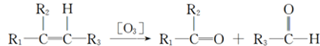
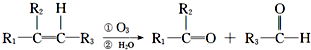
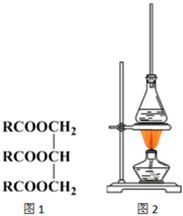 油脂是高级脂肪酸的甘油酯,其结构可以表示为图1(R为相同基团).利用油脂的皂化反应和滴定法可以测定油脂的平均分子量.回答下列问题:
油脂是高级脂肪酸的甘油酯,其结构可以表示为图1(R为相同基团).利用油脂的皂化反应和滴定法可以测定油脂的平均分子量.回答下列问题: