题目内容
18.室温下,使用pH计测定0.1mol/L NH4Cl溶液的pH=5.12.由此可以得到的结论是 ( )| A. | 溶液中c(H+)>c(OH-) | |
| B. | NH4+水解是微弱的 | |
| C. | NH3•H2O是弱碱 | |
| D. | 由H2O电离出的c(H+)<10-7 mol/L | |
| E. | 物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7 |
分析 室温下,使用pH计测定0.1mol/L NH4Cl溶液的pH=5.12,说明氯化铵水解呈酸性,为强酸弱碱盐,则NH3•H2O是弱碱,以此解答该题.
解答 解:溶液的pH=5.12,呈酸性.
A.溶液呈酸性,c(H+)>c(OH-),故A正确;
B.pH=5.12,溶液呈弱酸性,则NH4+水解是微弱的,故B正确;
C.氯化铵水解呈酸性,为强酸弱碱盐,则NH3•H2O是弱碱,故C正确;
D.盐类水解促进电离,则由H2O电离出的c(H+)>10-7 mol/L,故D错误;
E.物质的量浓度相等的氨水和盐酸等体积混合,恰好生成氯化铵,发生水解,溶液呈酸性,故D错误.
故选ABC.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生的分析能力,注意把握弱电解质的电离以及盐类水解的特点,把握水的电离平衡的影响因素,难度不大.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
9.某电动汽车配载一种可充放电的锂电子电池.放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+C6(x<1).下列关于该电池的说法不正确的是( )
| A. | 放电时,Co元素的化合价升高 | |
| B. | 放电时,正极的电极反应式为Lil-xCoO2+xe-+xLi+=LiCoO2 | |
| C. | 充电时,Li+在电解质中由阳极向阴极迁移 | |
| D. | 充电时,阴极的电极反应式为C6+xLi++xe-=LixC6 |
6.常吃菠菜可以补铁,这里的“铁”是指( )
| A. | 分子 | B. | 元素 | C. | 原子 | D. | 单质 |
10.由羟基与下列基团组成的化合物中,属于醇类的是( )
| A. | NH2- | B. |  | C. |  | D. | R-CO- |
7.(1)25℃时,在0.1L 0.2mol•L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH=2.
(2)25℃时,若向0.1mol/L氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/L,则c(SO42-)=0.5amol/L.
(3)室温下,若向0.1mol/L氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-).
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
回答下列问题
?25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.
?向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3.
(5)常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是1:4.
(2)25℃时,若向0.1mol/L氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/L,则c(SO42-)=0.5amol/L.
(3)室温下,若向0.1mol/L氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-).
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |
?25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.
?向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3.
(5)常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是1:4.
9.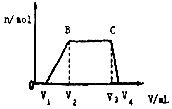 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示.则该溶液中一定不含有的离子是Mg2+、Fe2+、Fe3+、CO32-、AlO2-.
(2)BC段离子方程式为NH4++OH-═NH3•H2O.
(3)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
①a=0.15.
②当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为Cl2+2I-=I2+2Cl-.
③原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(2)BC段离子方程式为NH4++OH-═NH3•H2O.
(3)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| N(I-) | a mol | 0 | 0 |
②当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为Cl2+2I-=I2+2Cl-.
③原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
 .
.