题目内容
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 过氧化钠与水反应时,生成2.24L氧气转移的电子数为0.2NA | |
| B. | 1L 0.1mol•L-1的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| C. | 标准状况下,2.24L三氯甲烷分子中含有共价键总数为0.4NA | |
| D. | 15g${\;}_{\;}^{14}{C}_{\;}^{16}O$和15g${\;}_{\;}^{12}{C}_{\;}^{18}O$中含有的中子数均为8NA |
分析 A.气体的状态未知;
B.HS-水解生成硫化氢;
C.标准状况三氯甲烷不是气体;
D.${\;}_{\;}^{14}{C}_{\;}^{16}O$和15g${\;}_{\;}^{12}{C}_{\;}^{18}O$中含有的中子数均为16,分子量均为30.
解答 解:A.气体的状态未知,不一定在标况下,无法计算物质的量,故A错误;
B.HS-水解生成硫化氢,HS-和S2-离子数之和小于0.1NA,故B错误;
C.标准状况下三氯甲烷不是气体,2.24L三氯甲烷不是0.1mol,含有分子数目不是0.1NA,故C错误;
D.${\;}_{\;}^{14}{C}_{\;}^{16}O$和15g${\;}_{\;}^{12}{C}_{\;}^{18}O$中含有的中子数均为16,分子量均为30,15g${\;}_{\;}^{14}{C}_{\;}^{16}O$和15g${\;}_{\;}^{12}{C}_{\;}^{18}O$的物质的量为0.5mol,含有的中子数均为8NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,盐类水解的分析,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.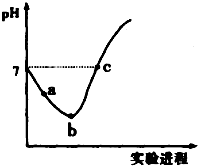 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是( )
 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是( )| A. | 向a 点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| B. | b 点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 由a 点到b 点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$ 减小 | |
| D. | c 点所示溶液中:c(Na+ )=2c(ClO-)+c(HClO) |
14.已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ•mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的释放或吸收的热量为( )
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的释放或吸收的热量为( )
| A. | 放出218 kJ | B. | 放出109kJ | C. | 吸收218 kJ | D. | 吸收109 kJ1 |
4.下列各组分子中,都由极性键构成的极性分子的一组是( )
| A. | CCl4和H2S | B. | H2O和NH3 | C. | CH4和CO2 | D. | H2O2和SO2 |
11.某温度时,一定压强下的密闭容器中反生反应:aX(g)+bY(g)?cZ(g)+dW(g),达平衡后保持温度不变,体积减小至原来的一半,再达平衡时Z的浓度变为原平衡状态的1.7倍,下列叙述正确是( )
| A. | 平衡正向移动 | B. | (a+b)>(c+d) | C. | X的转化率变大 | D. | Z的体积分数变小 |