题目内容
9.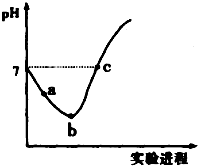 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是( )| A. | 向a 点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| B. | b 点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 由a 点到b 点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$ 减小 | |
| D. | c 点所示溶液中:c(Na+ )=2c(ClO-)+c(HClO) |
分析 整个过程发生的反应为Cl2+H2O═HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,根据溶液的酸碱性结合电荷守恒和物料守恒分析解答.
解答 解:A、氯气具有氧化性,能将二氧化硫氧化为硫酸,自身被还原为盐酸,所得到的溶液不再具有漂白性,故A错误;
B、b 点所示溶液中发生反应:Cl2+H2O=H++Cl-+HClO,HClO为弱电解质,部分电离,溶液中存在的粒子有:H+、Cl-、ClO-、OH-,H2O、HClO、Cl2,溶液中:c(H+)>c(Cl-)>c(HClO)>c(ClO-),故B错误;
C、由a点到b点的过程是氯气的溶解平衡Cl2+H2O?H++Cl-+HClO向右进行的过程,酸性逐渐增强,氢离子浓度逐渐增大,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$ 增大,故C错误;
D、c点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(Cl0-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),根据物料守恒得c(Cl-)=c(ClO-)+c(HClO),所以c(Na+)=c(HClO)+2c(ClO-),故D正确.
故选D.
点评 本题综合考查氯气的性质,侧重于学生的分析能力的考查,注意理解溶液中的溶质及其性质是解本题关键,根据物料守恒得c(Cl-)=c(ClO-)+c(HClO),为易错点,难度中等.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
15.某硝酸盐M(NO3)2热分解化学方程式为:2M(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MO+4NO2↑+O2↑,加热18.8g
M(NO3)2使其完全分解,共收集5.6L气体(标准状况下),则M摩尔质量为( )
M(NO3)2使其完全分解,共收集5.6L气体(标准状况下),则M摩尔质量为( )
| A. | 64 g•mol-1 | B. | 24 g•mol-1 | C. | 56 g•mol-1 | D. | 188 g•mol-1 |
17.下列有关化学用语表示正确的是( )
| A. | CO 2分子比例模型: | B. | S 2-的结构示意图: | ||
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | D. | HCN分子的结构式:H-C≡N |
4.下列装置能达到实验目的是( )
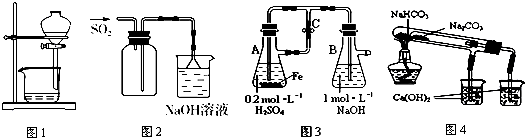

| A. | 图1用于放出碘的苯溶液 | |
| B. | 图2用于实验室收集SO2 | |
| C. | 图3用于实验室制备Fe(OH)2 | |
| D. | 图4用于比较NaHCO3和Na2CO3热稳定性 |
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol/L KNO3溶液:、H+、Fe2+、Al3+、Cl- | |
| B. | 酸性溶液:NH4+、Fe2+、K+、SO42- | |
| C. | 碱性溶液:ClO-、SO32-、K+、Na+ | |
| D. | 与铝反应产生大量氢气的溶液:K+、Cl-、CO32-、Na+ |
18.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:

已知:气体分压(p分)=气体总压(p总)×体积分数.下列说法正确的是( )

已知:气体分压(p分)=气体总压(p总)×体积分数.下列说法正确的是( )
| A. | 550℃时,若充入惰性气体,v正、v逆 均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为75.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向正反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=23.04 p总 |
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 过氧化钠与水反应时,生成2.24L氧气转移的电子数为0.2NA | |
| B. | 1L 0.1mol•L-1的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| C. | 标准状况下,2.24L三氯甲烷分子中含有共价键总数为0.4NA | |
| D. | 15g${\;}_{\;}^{14}{C}_{\;}^{16}O$和15g${\;}_{\;}^{12}{C}_{\;}^{18}O$中含有的中子数均为8NA |