题目内容
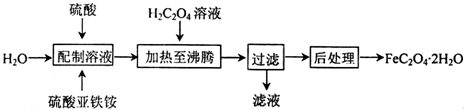
19.三氯化铬是合成其它铬盐的重要原料,在无机合成和有机合成中有重要的作用,是合成饲料添加剂的主要成份,工业上主要用作媒染剂及催化剂.易溶于水,溶于乙醇,几乎不溶于乙醚,易潮解,易升华.在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)且2CrO42-+2H+?Cr2O72-+H2O.制三氯化铬的流程如下:
(1)三氯化铬碱性条件下被H2O2氧化为Cr(Ⅵ)的离子反应方程式为2Cr3++3H2O2+10OH-=2CrO42-+8H2O.
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是水浴加热(并用温度计指示温度).
(3)用如图装置制备CrCl3时,主要步骤包括:

①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通入氮气,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性.
正确的操作顺序为:⑥→③→_②→④→⑤→①,步骤②中通如氮气的作用将CCl4蒸汽载入反应装置中;赶走空气,防止CrCl3被氧化.
(4)已知反应管中发生的主要反应有:Cr2O3+3CCl4→2CrCl3+3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式COCl2+2C2H5OH→C2H5OCOC2H5+2HCl.
(5)样品中三氯化铬质量分数的测定称取样品0.3300g,加水溶解并定容于250mL容量瓶中.移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL.
已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2═Na2S4O6+2NaI.
①指示剂为淀粉,滴定终点的现象为最后一滴滴入时,蓝色恰好完全褪去,且半分钟内不恢复原色.
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是除去其中溶解的氧气,防止氧气将I-氧化,产生偏高的误差.
③样品中无水三氯化铬的质量分数为96.1%.(计算结果精确到0.1%)
分析 根据流程图知,重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)、氮气和水,然后洗涤、烘干得到Cr2O3,在加热条件下,在反应器中发生反应Cr2O3+3CCl4═2CrCl3+3COCl2,三氯化铬易升华,在高温下能被氧气氧化,为防止三氯化铬被氧化,通入氮气,且充入的氮气能使反应物进入管式炉中进行反应;最后得到无水三氯化铬,
(1)三氯化铬碱性条件下被H2O2氧化为铬酸根,根据电荷守恒和元素守恒书写离子方程式;
(2)因为CCl4沸点为76.8℃,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量;
(3)由(4)可知反应制备原理为Cr2O3+3CCl4→2CrCl3+3COCl2,四氯化碳在管式炉中反应管与Cr2O3反应,反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源,停止加热CCl4,继续通入氮气,将产物收集到蒸发皿;步骤②中通入氮气,可以将CCl4蒸汽载入反应装置中;赶走空气,防止CrCl3被氧化,据此答题;
(4)由分子式可知,COCl2中的2个Cl原子被2个-OC2H5代替,故乙醇与COCl2发生取代反应,-OC2H5取代氯原子生成C2H5OCOC2H5与HCl;
(5)①利用Na2S2O3滴定生成I2,I2遇淀粉显蓝色;滴入最后一滴时,如果溶液颜色在半分钟内不变色,则达到滴定终点;
②溶液中有溶解的氧气,氧气可以氧化I-氧化,若不除去其中溶解的氧气使生成的I2的量增大,产生偏高的误差;
③由Cr元素守恒及方程式可得关系式2Cr3++~Cr2O72-~3I2~6Na2S2O3,根据关系式计算;
解答 解:(1)三氯化铬碱性条件下被H2O2氧化为铬酸根,根据电荷守恒和元素守恒可知离子方程式为2Cr3++3H2O2+10OH-=2CrO42-+8H2O,
故答案为:2Cr3++3H2O2+10OH-=2CrO42-+8H2O;
(2)因为CCl4沸点为76.8℃,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量,并用温度计指示温度,
故答案为:水浴加热(并用温度计指示温度);
(3)由(4)可知反应制备原理为Cr2O3+3CCl4→2CrCl3+3COCl2,四氯化碳在管式炉中反应管与Cr2O3反应,反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源,停止加热CCl4,继续通入氮气,将产物收集到蒸发皿,故操作顺序为:⑥→③→②→④→⑤→①,步骤②中通入氮气,可以将CCl4蒸汽载入反应装置中;赶走空气,防止CrCl3被氧化,
故答案为:②→④→⑤→①;将CCl4蒸汽载入反应装置中;赶走空气,防止CrCl3被氧化;
(4)由分子式可知,COCl2中的2个Cl原子被2个-OC2H5代替,故乙醇与COCl2发生取代反应,-OC2H5取代氯原子生成C2H5OCOC2H5与HCl,反应方程式为COCl2+2C2H5OH→C2H5OCOC2H5+2HCl,
故答案为:COCl2+2C2H5OH→C2H5OCOC2H5+2HCl;
(5)①利用Na2S2O3滴定生成I2,I2遇淀粉显蓝色,所以可以用淀粉作指示剂;滴入最后一滴时,如果溶液颜色在半分钟内不变色,则达到滴定终点,
故答案为:淀粉;最后一滴滴入时,蓝色恰好完全褪去,且半分钟内不恢复原色;
②溶液中有溶解的氧气,氧气可以氧化I-氧化,若不除去其中溶解的氧气使生成的I2的量增大,产生偏高的误差,故加热煮沸,其主要原因是:除去其中溶解的氧气,防止氧气将I-氧化,产生偏高的误差,
故答案为:除去其中溶解的氧气,防止氧气将I-氧化,产生偏高的误差;
③令25.00mL溶液中n(Cr3+),由Cr元素守恒及方程式可得关系式2Cr3++~Cr2O72-~3I2~6Na2S2O3,根据关系式计算,
2Cr3++~Cr2O72-~3I2~6Na2S2O3,
2 6
n(Cr3+) 0.0250mol/L×0.024L
故n(Cr3+)=0.0250mol/L×0.024L×$\frac{1}{3}$,所以250mL溶液中n′(Cr3+)=0.0250mol/L×0.024L×$\frac{1}{3}$×$\frac{250mL}{25mL}$=0.002mol,根据Cr元素守恒可知n(CrCl3)=n′(Cr3+)=0.002mol,所以样品中m(CrCl3)=0.002mol×158.5g/mol=0.317g,故样品中无水三氯化铬的质量分数为$\frac{0.317g}{0.33g}$×100%=96.1%.
故答案为:96.1%.
点评 本题考查学生对的实验方案原理的理解与评价、物质组成含量的测定、滴定应用、化学计算等,题目难度较大,理清实验原理是关键,是对学生综合能力想考查,需要学生具备扎实的基础知识.


25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 4.7 |
| 完成沉淀pH | 3.2 | 9.7 | 6.7 |
(1)流程中加入的试剂a最合适的是C(填序号)
A.酸性高锰酸钾溶液 B.NaClO溶液 C.H2O2溶液 D.稀硝酸
加入试剂a的目的是将Fe2+氧化.
(2)调节pH约4应该加入的物质可以是AC.
A.CuO B.CuCl2 C.Cu(OH)2 D.NaOH
(3)最后能不能直接蒸发结晶得到CuCl2•2H2O?不能(填“能”或“不能”).
| A. | 标准状况下,1.12LCCl4含有Cl原子数目为0.4NA | |
| B. | 标准状况下,2.24L氯气中含有的电子总数为3.4mol | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 39gNa2O2与足量H2O反应,转移电子数为NA |
| A. | 与铝反应产生大题氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| B. | 能使硫氰化钾溶液显红色的溶液:K+、SO42-、S2-、SO32- | |
| C. | 常温下pH值为13的溶液中:K+、HCO3-、Na+、Cl- | |
| D. | 在使石蕊试液变红的溶液中:Na+、Cu2+、Br-、SO42- |
| A. | Na2CO3 | B. | NaOH | ||
| C. | CH3COONa NaOH | D. | Na2CO3 CH3COONa |

 .
.