题目内容
6.NA代表阿伏伽德罗常数,下列说法正确的是( )| A. | 1.4g乙烯和丙烯混合气体中含有C-H键的数目为0.2NA | |
| B. | 0.10molFe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| C. | 标准状况下,11.2LCO2与足量Na2O2反应,转移的电子数为NA | |
| D. | 若将1mol氧化铁完全转化为氢氧化铁胶体,则分散系中胶体粒子数为NA |
分析 A.计算1.4g乙烯中含C-H键,计算1.4g丙烯中含C-H键,据此分析判断;
B.铁与水蒸气反应生成四氧化三铁和氢气,据此计算氢气的物质的量得到氢气分子数;
C.标准状况下,11.2LCO2的物质的量为0.5mol,而二氧化碳与过氧化钠反应时,1mol二氧化碳反应时,反应转移1mol电子;
D.1mol氧化铁含2mol三价铁,氢氧化铁胶体粒子是多个氢氧化铁的集合体.
解答 解:A.1.4g乙烯物质的量=$\frac{1.4g}{28g/mol}$=0.05mol,中含C-H键=0.05mol×4×NA=0.2NA,1.4g丙烯物质的量=$\frac{1.4g}{42g/mol}$,分子中含C-H键=$\frac{1.4}{42}$mol×6×NA=0.2NA,1.4g乙烯和丙烯混合气体中含有C-H键的数目为0.2NA,故A正确;
B.Fe粉与足量水蒸气反应的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,所以0.10molFe粉与足量水蒸气反应生成的H2分子数为$\frac{0.4}{3}$NA,故B错误;
C.标准状况下,11.2LCO2的物质的量为0.5mol,而二氧化碳与过氧化钠反应时,1mol二氧化碳反应时,反应转移1mol电子,故0.5mol二氧化碳反应时,反应转移0.5mol电子即0.5NA个,故C错误;
D.1mol氧化铁含2mol三价铁,氢氧化铁胶体粒子是多个氢氧化铁的集合体,形成的氢氧化铁胶体粒子数小于2NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,主要是气体摩尔体积、氧化还原反应,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
16.下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将一定量的NaNO3和KCl混合加热浓缩至有固体析出,过滤. | 有白色晶体析出 | 白色晶体为KNO3 |
| B | 向2mLNaCl和NaI(浓度均为0.1mol•L-1)混合溶液中滴入2滴0.1mol•L-1AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向某溶液中加入盐酸酸化的Ba(NO3)2溶液 | 出现白色沉淀 | 该溶液一定有SO42-或 Ag+ |
| D | 向淀粉水解液中加入新制的Cu(OH)2悬浊液,煮沸 | 没有生成(砖)红色沉淀 | 淀粉未水解 |
| A. | A | B. | B | C. | C | D. | D |
17.Cu和浓H2SO4反应得到25gCuSO4•5H2O,被还原的H2SO4是( )
| A. | 4.9g | B. | 8.0g | C. | 9.8g | D. | 19.6g |
1.下列说法不正确的是( )
| A. | 化学键的断裂与形成一定伴随着电子的转移和能量变化 | |
| B. | 碘晶体是分子晶体,加热升华过程中只需克服分子间作用力 | |
| C. | 二氧化硅晶体属于原子晶体,每个Si通过共价键与4个O结合 | |
| D. | 氯化钠的电离是一个破坏离子键的过程 |
11. 可逆反应L(s )+aG(g)?bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强Pl>P2.下列判断正确的是( )
可逆反应L(s )+aG(g)?bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强Pl>P2.下列判断正确的是( )
 可逆反应L(s )+aG(g)?bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强Pl>P2.下列判断正确的是( )
可逆反应L(s )+aG(g)?bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强Pl>P2.下列判断正确的是( )| A. | 1+a<b | |
| B. | △H<0 | |
| C. | a>b | |
| D. | 增加L的物质的量,可提高G的转化率 |
18.如图所示分离混合物时常用的仪器,从左至右,对应的混合物分离操作方法正确的是( )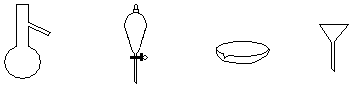

| A. | 蒸发、过滤、蒸馏、分液 | B. | 蒸馏、分液、蒸发、过滤 | ||
| C. | 蒸馏、过滤、蒸发、分液 | D. | 蒸发、分液、蒸馏、过滤 |
15.设 NA 为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下,28 g CO 和 C2H4混合气体中的碳原子数为 NA | |
| B. | 1 mol N2 与 3 mol H2 充分反应,产物的分子数为 2NA | |
| C. | 标准状况下,11.2 L 己烷中含有的碳碳键数为 2.5NA | |
| D. | 32 g 硫粉与足量的 Cu 粉完全反应,转移的电子数为 2NA |
16.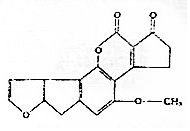 黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
 黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )| A. | 黄曲霉素分子中所有的原子均共面 | |
| B. | 黄曲霉素分子中含有2个手性碳原子 | |
| C. | 黄曲霉素可以发生取代,加成,氧化反应 | |
| D. | 1mol黄曲霉素最多能与7molH2发生加成反应 |
 .
.