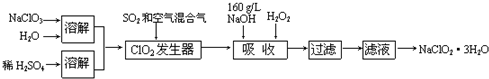
题目内容
某气体物质质量为6.4g,含有6.02×1022个分子,则该气体的相对分子质量为 .
考点:相对分子质量及其计算
专题:
分析:根据n=
,M=
进行计算,再根据相对分子质量与摩尔质量在数值上相等得出正确结论.
| N |
| NA |
| m |
| n |
解答:
解:n=
=
=0.1mol,M=
=
=64g/mol,相对分子质量与摩尔质量在数值上相等,故该气体的相对分子质量为64,
故答案为:64.
| N |
| NA |
| 6.02×1022 |
| 6.02×1023 |
| m |
| n |
| 6.4g |
| 0.1mol |
故答案为:64.
点评:本题考查相对分子质量的相关计算,难度不大.要注意相对分子质量与摩尔质量在数值上相等是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
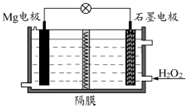 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A、Mg 电极是该电池的正极 |
| B、H2O2 在石墨电极上发生氧化反应 |
| C、石墨电极上的电极反应式为:H2O2+2e-=2OH- |
| D、导线中电子由正极流向负极,溶液中Cl-向正极移动 |
有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀.反应中消耗xmolH2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)/mol?L-1为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列说法中正确的是(NA表示阿伏加德罗常数)( )
| A、常温常压下,22.0 gCO2所含的电子数为22NA |
| B、常温常压下,1mol氦气含有原子数为NA |
| C、0.5mol?L-1 Na2CO3溶液中含有Na+离子的数目为NA |
| D、标准状况下,22.4LCCl4含有的氯原子数为4NA |
下列物质中,所含分子数最多的是(NA表示阿伏加德罗常数)( )
| A、10 g H2 |
| B、2 mol Cl2 |
| C、1.5 NA CO2 |
| D、22.4 L O2(标准状况) |
下列说法正确的是( )
| A、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| B、铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓船体的腐蚀速率 |
| C、其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,降低水的离子积 |
| D、能与酸反应的氧化物,一定是碱性氧化物 |