题目内容
18.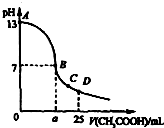 25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L-1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,不正确的是( )
25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L-1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,不正确的是( )| A. | C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | D点时c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| C. | 曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | B点的横坐标a=12.5ml |
分析 A.C点显酸性,醋酸过量,溶液中溶质为CH3COOH、CH3COONa;
B.根据物料守恒分析;
C.曲线上A、B间任一点,溶液显碱性,根据电荷守恒分析;
D.NaOH与醋酸恰好反应生成醋酸钠,溶液显碱性.
解答 解:A.C点显酸性,醋酸过量,溶液中溶质为CH3COOH、CH3COONa,所以c(CH3COO-)>c(Na+),醋酸电离的氢离子浓度较小,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A正确;
B.在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L-1的CH3COOH溶液,当醋酸的体积为25mL时,溶液中溶质是等浓度的CH3COOH、CH3COONa,由物料守恒可知c(CH3COO-)+c(CH3COOH)=2c(Na+),故B正确;
C.曲线上A、B间,溶液显碱性c(OH-)>c(H+),已知电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(Na+)>c(CH3COO-)>c(OH-)>c(H+),若溶液中加入很少量的醋酸,则c(OH-)>c(CH3COO-),故C错误;
D.在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L-1的CH3COOH溶液,当醋酸的体积为12.5ml时,NaOH与醋酸恰好反应生成醋酸钠,溶液显碱性,而a点显中性,说明醋酸的体积大于12.5mL,故D错误.
故选CD.
点评 本题考查了酸碱混合后的定性判断及溶液中离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,能够根据电荷守恒、物料守恒等比较溶液中离子浓度大小,试题培养了学生灵活应用的所学知识的能力.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
8.有4瓶常用溶液:①BaCl2溶液,②KCl溶液,③K2SO4溶液,④CuSO4溶液.不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是( )
| A. | ④③①② | B. | ①④②③ | C. | ①③④② | D. | ④①③② |
9.瑞典ASES公司设计的用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )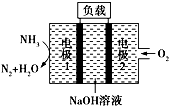

| A. | 电池工作时,电极2上发生氧化反应 | |
| B. | 电池工作一段时间后停止,溶液pH值比开始时明显增大 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
6.1摩某有机物在稀硫酸作用下,水解生成2摩相同的物质.下列物质中:
①蔗糖 ②麦芽糖 ③淀粉④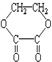 ⑤
⑤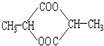 ⑥
⑥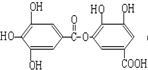 ⑦
⑦
符合题意的物质可能是( )
①蔗糖 ②麦芽糖 ③淀粉④
 ⑤
⑤ ⑥
⑥ ⑦
⑦
符合题意的物质可能是( )
| A. | ②⑤⑥⑦ | B. | ②④⑤⑦ | C. | ①②⑤⑦ | D. | ①④⑤⑥ |
13.生活中处处有化学.下列说法正确的是( )
| A. | 用少量食醋可以除去水壶中的水垢 | |
| B. | 做衣服用的棉和麻均与淀粉互为同分异构体 | |
| C. | 煎炸食物的花生油和牛油都是饱和烃基的酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
3.同温下两种醋酸溶液,A溶液的物质的量浓度为c,电离度为α,B溶液的c(CH3COO-)═c,电离度为α′.下列的有关叙述中,正确的是( )
| A. | α<α′ | B. | B溶液物质的量浓度为$\frac{c}{α′}$ | ||
| C. | A溶液的pH值等于B溶液的pH值 | D. | A溶液的[H+]与B溶液的[H+]之比为1:α′ |
7.元素周期表和元素周期律可以指导人们进行规律性的推测和判断.下列说法不合理的是( )
| A. | 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | |
| B. | 元素周期表中位于金属和非金属分界线附近能找到半导体的元素 | |
| C. | Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 | |
| D. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
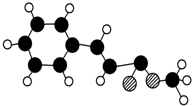 肉桂酸甲酯的球棍模型如图所示(图中球与球之间连线表示单键或双键).
肉桂酸甲酯的球棍模型如图所示(图中球与球之间连线表示单键或双键).