题目内容
15.洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在.有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘.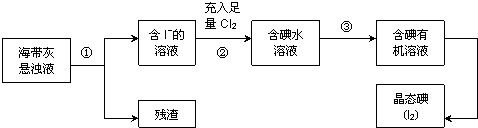
(1)灼烧海带时需要用到的实验仪器是ACDE(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.坩埚 B.坩埚钳 C.三脚架 D.泥三角E.酒精灯
(2)过程②中充入足量Cl2的目的是将I-全部氧化为I2,反应的离子方程式为Cl2+2I-=2Cl-+I2.
(3)操作③中所用的有机试剂可以是苯或CCl4(只填一种).
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂(你所选)加入分液漏斗中,盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,不时旋开活塞放气,后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层.
a.上述G步操作的目的是便于下层液体流出;
b.最后碘的有机溶液是通过(3)中选苯则填“漏斗上口”,(3)中选CCl4则填“漏斗下口”获得(填“漏斗上口”或“漏斗下口”).
(5)若要检验提取碘后的水溶液中是否还含有单质碘,可以取样加入淀粉溶液,观察颜色变化.
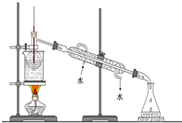
(6)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察图所示实验装置,指出其错误有3处.
分析 以海带为原料获得少量碘单质:将海带在坩埚中灼烧得到海带灰,将海带灰浸泡得到海带灰悬浊液,然后采用过滤的方法将残渣和溶液分离,得到含有碘化钾的溶液,向水溶液中通入足量Cl2,发生反应为2I-+Cl2=2Cl-+I2,向含有碘单质的溶液中加入萃取剂四氯化碳或苯萃取蒸馏得到碘单质,以此解答.
(1)根据仪器的作用和实验操作选取仪器;
(2)过滤后的滤液中含碘离子,可以被氧化为碘单质,充入足量Cl2将I-全部氧化为I2;
(3)萃取剂必须具备下列条件:碘在萃取剂中的溶解度大于在水中的溶解度,萃取剂和水不互溶,且萃取剂和碘不反应;
(4)a.分液漏斗使用时:将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,平衡气压;
b.密度大于水的萃取剂从下口流出,密度小于水的从上口倒出;
(5)根据碘单质遇到淀粉会变蓝色来检验是否还有碘单质;
(6)从含碘的有机溶液中提取碘和回收有机试剂,还需要经过蒸馏,对照蒸馏操作,如图错误为缺少石棉网,温度计水银球位置错误,冷凝水水流方向错误.
解答 解:由提取单质碘的实验流程可知,①为过滤,滤液中含碘离子,②中发生Cl2+2I-=I2+2Cl-,得到碘水溶液,③为萃取分液得到含碘的有机溶液.
(1)灼烧海带时用坩埚盛放海带,用带铁圈的铁架台或三脚架和泥三角上放置坩埚,用酒精灯进行加热,所以灼烧海带时需要用到的实验仪器是坩埚、带铁圈的铁架台或三脚架、泥三角、酒精灯,即ACDE,
故答案为:ACDE;
(2)步骤②用氯气置换碘离子,充入足量Cl2将I-全部氧化为I2,其反应离子方程式为2I-+Cl2=2Cl-+I2,
故答案为:将I-全部氧化为I2;Cl2+2I-=2Cl-+I2;
(3)萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,溶质和萃取剂不反应,萃取剂和原来溶剂不能互溶,苯或四氯化碳符合萃取剂的选取标准,所以可以用苯或四氯化碳作萃取剂,
故答案为:苯或四氯化碳;
(4)a.分液漏斗使用时:将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,可以平衡气压,便于液体流出,
故答案为:便于下层液体流出;
b.分液漏斗中的下层液体从下口漏出,上层液体从上口倒出,萃取剂四氯化碳的密度大于水,含有碘单质的四氯化碳在下层,从下口漏出,选用苯/汽油/煤油这些物质密度小于水,应从漏斗上口倒出,
故答案为:(3)中选苯则填“漏斗上口”,(3)中选CCl4则填“漏斗下口”;
(5)提取碘后的水溶液中若是含有单质碘,则遇到淀粉会变蓝色,可以取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果变蓝,说明还有单质碘,
故答案为:淀粉溶液;
(6)由图可知,烧瓶加热需要石棉网,温度计水银球应与烧瓶支管口相平,冷却水应下进上出,则错误为缺少石棉网,温度计水银球位置错误,冷凝水水流方向错误,共3处,
故答案为:3.
点评 本题考查了海水资源的综合利用,为高频考点,涉及知识点较多,把握实验流程及发生的反应、萃取剂的选取标准、蒸馏实验原理及装置等知识点为解答的关键,侧重高频考点的考查,题目难度中等.

| A. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 | |
| B. | 石油裂化主要得到乙烯 | |
| C. | 石油分馏是化学变化,可得到汽油、煤油 | |
| D. | 煤的气化是在高温下煤和水蒸气作用转化为可燃性气体的过程,属于物理变化 |
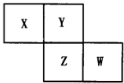 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | Z的单质与氢气反应较Y剧烈 | |
| B. | X、Y形成的化合物都易溶于水 | |
| C. | 这四种元素的单质以Z熔点最高 | |
| D. | 最高价氧化物对应水化物的酸性W比Z弱 |
| A. | 苯 | B. | 乙醇 | C. | 溴苯 | D. | 四氯化碳 |
| A. | Cl | B. | F | C. | S | D. | C |
| A. | 反应物和生成物的浓度改变 | B. | 反应体系的压强改变 | ||
| C. | 正、逆反应的速率改变 | D. | 反应物的转化率改变 |
①2HClO4+Br2(g)═2HBrO4+Cl2
②2NaBr+Cl2═NaCl+Br2
③2KI+Cl2═2KCl+I2④2KI+Br2═2KBr+I2.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
| A. | 1L水中溶解5.85gNaCl所形成溶液物质的量浓度是0.1mol•L-1 | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 标准状况下,22.4L单质溴所含有的原子数目为2NA | |
| D. | 3.4gNH3中含N-H键数目为0.2NA |
| A. | N2 | B. | S2- | C. | NH4+ | D. | HCl |