题目内容
9.表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述错误的是( )| 元素代号 | L | M | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | M与T形成的化合物具有两性 | ||
| C. | 气态氢化物的稳定性为H2T>H2R | D. | L和M金属性强弱比较:L>M |
分析 短周期元素中,T、R都有-2价,处于ⅥA族,T只有-2价,R有+6价,且R的原子半径较大,则T为O元素、R为S元素,L有+2价,处于ⅡA族,L的原子半径大于硫的,则L为Mg元素,M有+3价,处于ⅢA族,原子半径M的介于Mg、S之间,则M为Al元素,结合元素周期律解答.
解答 解:短周期元素中,T、R都有-2价,处于ⅥA族,T只有-2价,R有+6价,且R的原子半径较大,则T为O元素、R为S元素,L有+2价,处于ⅡA族,L的原子半径大于硫的,则L为Mg元素,M有+3价,处于ⅢA族,原子半径M的介于Mg、S之间,则M为Al元素.
A.L2+的核外电子数为12-2=10,R2-的核外电子数为16-(-2)=18,则核外电子数不相等,故A错误;
B.M与T形成的化合物是氧化铝,属于两性氧化物,故B正确;
C.氢化物稳定性与元素非金属性一致,非金属性O>S,故氢化物稳定性H2O>H2S,故C正确;
D.同周期自左而右元素金属性减弱,故金属性Mg>Al,故D正确.
故选A.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
8.已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体;
②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断不正确的是( )
②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断不正确的是( )
| A. | 实验③说明KI被氧化 | |
| B. | 实验②中氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 实验①证明Cl-具有还原性 | |
| D. | 上述实证明氧化性:ClO3->Cl2>I2 |
17.下列说法正确的是( )
| A. | 存在 2,2-二甲基-3-戊炔 | |
| B. | 月桂烯分子中( 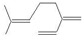 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | CF2Cl2存在两种同分异构体 | |
| D. | 用红外光谱法可鉴别二甲醚和乙醇 |
4.盐酸与氢氧化钠溶液相互滴定的滴定曲线如图,下列叙述正确的( )


| A. | 酚酞不能用作本实验的指示剂 | |
| B. | 盐酸的物质的量浓度为1mol?L-1 | |
| C. | P点时恰好完全中和,溶液呈中性 | |
| D. | 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线 |
19.下列各组中属于同位素关系的是( )
| A. | ${\;}_{3}^{6}$Li与${\;}_{3}^{7}$Li | B. | D2O与H2O | ||
| C. | ${\;}_{6}^{14}$C与${\;}_{7}^{14}$N | D. | 金刚石与石墨 |